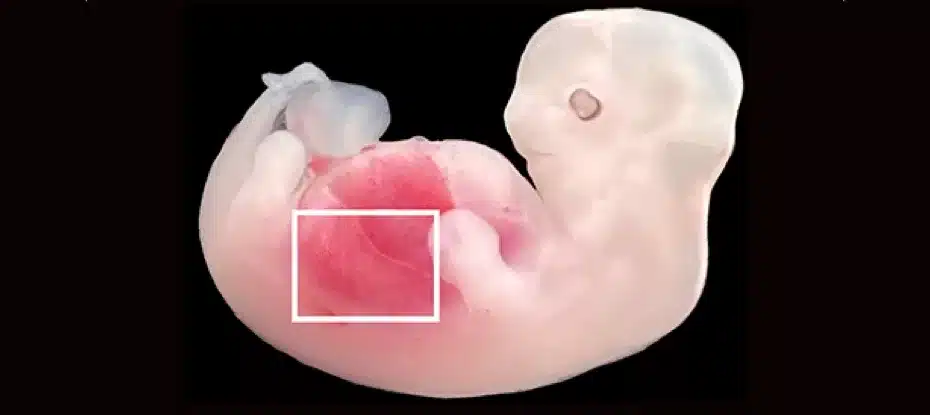
Cientistas chineses conseguiram cultivar rins contendo células humanas em embriões de porcos, uma inovação mundial que poderá um dia ajudar a resolver a escassez de doação de órgãos.
Mas o desenvolvimento, descrito num estudo publicado na revista Cell Stem Cell na quinta-feira, levanta questões éticas – especialmente porque algumas células humanas também foram encontradas nos cérebros dos porcos, disseram os especialistas.
Os pesquisadores dos Institutos de Biomedicina e Saúde de Guangzhou concentraram-se nos rins porque são um dos primeiros órgãos a se desenvolver e os mais comumente transplantados na medicina humana.
“Órgãos de ratos foram produzidos em camundongos e órgãos de camundongos foram produzidos em ratos, mas tentativas anteriores de cultivar órgãos humanos em porcos não tiveram sucesso”, disse o autor sênior Liangxue Lai em um comunicado.
“Nossa abordagem melhora a integração das células humanas nos tecidos receptores e nos permite cultivar órgãos humanos em porcos”.
Esta é uma abordagem diferente das recentes descobertas de grande visibilidade nos Estados Unidos, onde rins de porcos geneticamente modificados e até mesmo um coração foram colocados dentro de humanos.
O novo artigo “descreve passos pioneiros numa nova abordagem à bioengenharia de órgãos, utilizando porcos como incubadoras para o cultivo e cultivo de órgãos humanos”, disse Dusko Ilic, professor de ciências de células estaminais no King’s College London, que não esteve envolvido na investigação.
Ilic advertiu que haveria muitos desafios para transformar a experiência numa solução viável, mas “no entanto, esta estratégia cativante merece uma exploração mais aprofundada”.
Edição genética
Um grande desafio na criação de tais híbridos tem sido que as células suínas superam as células humanas.
Para superar os obstáculos, a equipe usou a edição genética CRISPR para excluir dois genes essenciais para a formação de rins dentro de um embrião de porco, criando o que é chamado de “nicho”.
Eles então adicionaram células-tronco pluripotentes humanas especialmente preparadas – células que têm potencial para se desenvolver em qualquer tipo de célula – que preencheram o nicho.
Antes de implantar os embriões nas porcas, eles os cultivaram em tubos de ensaio contendo substâncias que nutriam as células humanas e suínas.
No total, transferiram 1.820 embriões para 13 mães de aluguel. As gestações foram interrompidas aos 25 e 28 dias para avaliar como o experimento funcionou.

Descobriu-se que cinco embriões selecionados para análise apresentavam rins funcionalmente normais para seu estágio de desenvolvimento, começando a crescer os ureteres que eventualmente os conectariam à bexiga.
Eles continham entre 50 e 60 por cento de células humanas.
“Descobrimos que se você criar um nicho no embrião do porco, as células humanas irão naturalmente para esses espaços”, disse o coautor Zhen Dai.
“Vimos apenas muito poucas células neurais humanas no cérebro e na medula espinhal e nenhuma célula humana na crista genital”.
Prevenir a invasão de células humanas no tecido reprodutivo é considerado crucial, caso contrário existe o risco de criação descontrolada de híbridos humano-porco.
Mas a presença de células humanas nos cérebros dos porcos ainda suscita preocupações, disse Darius Widera, professor de biologia de células estaminais na Universidade de Reading.
“Embora esta abordagem seja um marco claro e a primeira tentativa bem sucedida de cultivar órgãos inteiros contendo células humanas em porcos, a proporção de células humanas nos rins gerados ainda não é suficientemente elevada”, acrescentou.
A longo prazo, a equipe quer otimizar a sua tecnologia para utilização em transplantes humanos, mas admite que ainda não está pronta.
Uma limitação importante era que os rins tinham células vasculares derivadas de porcos, que poderiam causar rejeição se transplantadas para um ser humano.
No entanto, os cientistas planeiam prosseguir e permitir que os rins se desenvolvam por mais tempo. Eles também estão trabalhando no cultivo de outros órgãos humanos em porcos, como o coração e o pâncreas.
Traduzido por Mateus Lynniker de ScienceAlert