Por Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raúl Gómez Román, Stig Tollefsen, Melanie Saville e Stephen Mayhew
Publicado na Nature
A sequência genética do SARS-CoV-2, o coronavírus que causa a COVID-19, foi publicada em 11 de janeiro de 2020, desencadeando intensa atividade global de P&D para desenvolver uma vacina contra a doença. A escala do impacto humanitário e econômico da pandemia de COVID-19 está impulsionando a avaliação de plataformas de tecnologia de vacina da próxima geração por meio de novos paradigmas para acelerar o desenvolvimento, e o primeiro candidato a vacina COVID-19 entrou em testes clínicos em humanos com rapidez sem precedentes em 16 de março de 2020.
A Coalizão de Inovações em Preparação para Epidemias (CEPI) está trabalhando com autoridades globais de saúde e desenvolvedores de vacinas para apoiar o desenvolvimento de vacinas contra a COVID-19. Para facilitar esse esforço, desenvolvemos e mantemos continuamente uma visão geral do cenário global da atividade de desenvolvimento de vacinas COVID-19. Nosso banco de dados inclui programas de desenvolvimento de vacinas relatados na lista autorizada e continuamente atualizada da OMS, além de outros projetos identificados a partir de fontes proprietárias e disponíveis ao público (consulte o Quadro 1). O cenário fornece insights sobre as principais características da pesquisa e desenvolvimento de vacinas COVID-19 e serve como um recurso para o gerenciamento contínuo do portfólio no CEPI. Também compartilhamos nossas informações de paisagem com outras pessoas no ecossistema de saúde global para ajudar a melhorar a coordenação na resposta ao surto de COVID-19 e permitir que recursos e capacidades globais sejam direcionados para os candidatos a vacinas mais promissores.
Cenário de P&D de vacinas para COVID-19
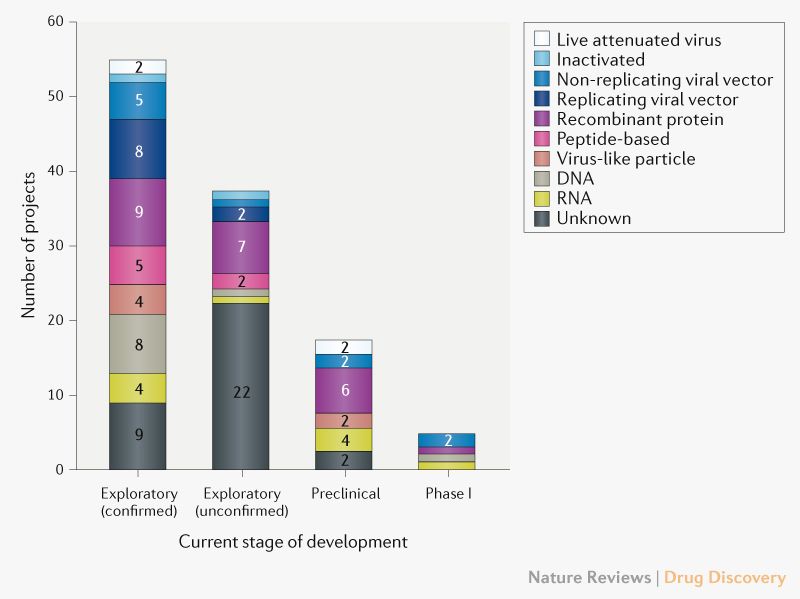
Em 8 de abril de 2020, o cenário global de pesquisa e desenvolvimento de vacinas COVID-19 inclui 115 candidatas a vacinas (Fig. 1), das quais 78 são confirmadas como ativas e 37 não são confirmadas (o status do desenvolvimento não pode ser determinado a partir de fontes de informação proprietárias ou disponíveis ao público). Dos 78 projetos ativos confirmados, 73 estão atualmente em fase exploratória ou pré-clínica. Os candidatos mais avançados mudaram-se recentemente para o desenvolvimento clínico, incluindo mRNA-1273 da Moderna, Ad5-nCoV da CanSino Biologicals, INO-4800 da Inovio, LV-SMENP-DC e aAPC específico para patógenos do Shenzhen Geno-Immune Medical Institute (Tabela 1) Vários outros desenvolvedores de vacinas indicaram planos para iniciar testes em humanos em 2020.
Quadro 1 Vacinas candidatas em fase clínica para COVID-19
| Candidato | Características da vacina | Desenvolvedor-chefe | Status |
| mRNA-1273 | Vacina de mRNA encapsulada em LNP que codifica proteína S | Moderna | Fase I (NCT04283461) |
| Ad5-nCoV | Vetor de adenovírus tipo 5 que expressa a proteína S | CanSino Biologicals | Fase I (NCT04313127) |
| INO-4800 | Plasmídeo de DNA que codifica proteína S entregue por eletroporação | Inovio Pharmaceuticals | Fase I (NCT04336410) |
| LV-SMENP-DC | Células Dendrítica (DCs) modificadas com vetor lentiviral que expressam minigene sintético com base em domínios de proteínas virais selecionadas; administrado com CTL específicos para antígenos | Instituto Médico Geno-Imune de Shenzhen | Fase I (NCT04276896) |
| AAPC específico para patógenos | aAPCs modificados com vetor lentiviral que expressam minigene sintético com base em domínios de proteínas virais selecionadas | Instituto Médico Geno-Imune de Shenzhen | Fase I (NCT04299724) |
aAPC, célula artificial de apresentação de antígeno; CTL, linfócito T citotóxico; DC, célula dendrítica; LNP, nanopartícula lipídica; Proteína S, proteína do spike do SARS-CoV-2. Fonte: ClinicalTrials.gov; WHO.
Diversidade de plataformas tecnológicas. Uma característica marcante do cenário de desenvolvimento de vacinas para COVID-19 é a variedade de plataformas tecnológicas que estão sendo avaliadas, incluindo ácido nucleico (DNA e RNA), partícula semelhante a vírus, peptídeos, vetor viral (replicante e não replicante), proteína recombinante, abordagens de vírus vivo atenuado e vírus inativado (Fig. 1). Atualmente, muitas dessas plataformas não são a base para vacinas licenciadas, mas a experiência em áreas como oncologia está incentivando os desenvolvedores a explorar as oportunidades que as abordagens de próxima geração oferecem para maior velocidade de desenvolvimento e fabricação. É concebível que algumas plataformas de vacina possam ser mais adequadas a subtipos específicos de população (como idosos, crianças, mulheres grávidas ou pacientes imunocomprometidos).
Considerando os candidatos na Tabela 1, as novas plataformas baseadas em DNA ou mRNA oferecem grande flexibilidade em termos de manipulação de antígenos e potencial de velocidade. De fato, a Moderna, empresa de biotecnologia, iniciou o teste clínico de sua vacina mRNA-1273 apenas 2 meses após a identificação da sequência. As vacinas baseadas em vetores virais oferecem um alto nível de expressão de proteínas e estabilidade a longo prazo e induzem fortes respostas imunes. Finalmente, já existem vacinas licenciadas com base em proteínas recombinantes para outras doenças e, portanto, esses candidatos poderiam tirar proveito da capacidade de produção em larga escala existente.
Para algumas plataformas, os adjuvantes podem aumentar a imunogenicidade e viabilizar doses mais baixas, possibilitando a vacinação de mais pessoas sem comprometer a proteção. Até o momento, pelo menos 10 desenvolvedores indicaram planos para desenvolver vacinas adjuvantes contra COVID-19, e desenvolvedores de vacinas, incluindo GlaxoSmithKine, Seqirus e Dynavax, se comprometeram a disponibilizar adjuvantes licenciados (AS03, MF59 e CpG 1018, respectivamente) para uso com as novas vacinas para COVID-19 desenvolvidas por outros.
A informação pública sobre os antígenos específico do SARS-CoV-2 usados no desenvolvimento da vacina é limitada. A maioria dos candidatos cujas informações estão disponíveis tem como objetivo induzir anticorpos neutralizantes contra a proteína spike (S) do vírus, impedindo a captação pelo receptor ECA2 humano. No entanto, não está claro como as diferentes formas e/ou variantes da proteína S usadas em diferentes candidatos se relacionam entre si ou com a epidemiologia genômica da doença. A experiência com o desenvolvimento da vacina para a SARS indica o potencial de efeitos do aprimoramento imunológico de diferentes antígenos, que é um tópico de debate e pode ser relevante no progresso da vacina.
Perfil dos desenvolvedores de vacinas. Dos candidatos ativos confirmados, 56 (72%) estão sendo desenvolvidos por indústrias privadas, com os 22 restantes (28%) dos projetos sendo liderados por acadêmicos, setor público e outras organizações sem fins lucrativos (Fig. 2). Embora vários desenvolvedores multinacionais de grandes vacinas (como Janssen, Sanofi, Pfizer e GlaxoSmithKine) tenham se engajado no desenvolvimento de vacinas COVID-19, muitos dos principais desenvolvedores são pequenos e/ou inexperientes na fabricação de vacinas em larga escala. Portanto, será importante garantir a coordenação da capacidade de fabricação e fornecimento de vacinas e capacidade de atender à demanda.
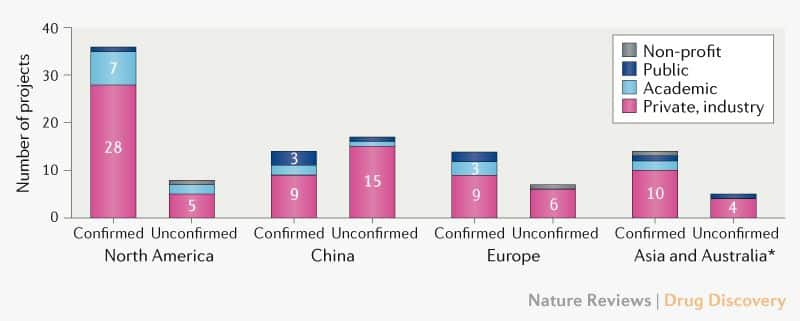
A maioria das atividades de desenvolvimento de vacinas COVID-19 ocorre na América do Norte, com 36 (46%) desenvolvedores dos candidatos a vacinas ativas confirmadas, em comparação com 14 (18%) na China, 14 (18%) na Ásia (excluindo China) e Austrália, e 14 (18%) na Europa (fig. 2). Esforços adicionais de desenvolvimento de vacinas foram relatados para a China e o CEPI está em diálogo com o Ministério de Ciência e Tecnologia da China para confirmar seu status.
Os principais desenvolvedores de vacinas ativas COVID-19 estão distribuídos em 19 países, que representam coletivamente mais de três quartos da população global. No entanto, atualmente não há informações públicas sobre a atividade de desenvolvimento de vacinas na África ou na América Latina, embora exista capacidade de fabricação de vacinas e estruturas regulatórias nessas regiões. A epidemiologia da COVID-19 pode diferir em termos geográficos, e é provável que o controle efetivo da pandemia exija maior coordenação e envolvimento do hemisfério sul nos esforços de pesquisa e desenvolvimento de vacinas.
Visão geral
O esforço global de pesquisa e desenvolvimento de vacinas em resposta à pandemia da COVID-19 é sem precedentes em termos de escala e velocidade. Dado o imperativo de velocidade, há uma indicação de que a vacina poderia estar disponível sob uso de emergência ou protocolos semelhantes até o início de 2021. Isso representaria uma mudança fundamental no caminho tradicional de desenvolvimento da vacina, que leva em média 10 anos, mesmo em comparação com o cronograma acelerado de cinco anos para o desenvolvimento da primeira vacina contra o Ebola e exigirá novos paradigmas de desenvolvimento de vacinas que envolvam fases de desenvolvimento paralelo e adaptativo, processos regulatórios inovadores e capacidade de fabricação em escala.
Os parâmetros de referência da indústria para paradigmas tradicionais de desenvolvimento de vacinas citam taxas de atrito para vacinas licenciadas de mais de 90%. As abordagens aplicadas ao desenvolvimento da COVID-19 — que envolvem um novo alvo de vírus e muitas vezes novas plataformas de tecnologia de vacinas e novos paradigmas de desenvolvimento — provavelmente aumentarão os riscos associados à entrega de uma vacina licenciada e exigirão uma avaliação cuidadosa da eficácia e segurança em cada etapa. Para avaliar a eficácia da vacina, modelos animais específicos para COVID-19 estão sendo desenvolvidos com ECA2 transgênico, incluindo camundongos, hamsters, furões e primatas não humanos. São necessárias medidas de contenção de nível de biossegurança 3 para estudos em animais que envolvam desafios com vírus vivos, e é provável que a demanda por esses recursos exija coordenação internacional para garantir a disponibilidade de capacidade laboratorial suficiente.
Por fim, será necessária uma forte coordenação e cooperação internacional entre desenvolvedores, reguladores, formuladores de políticas, financiadores, órgãos de saúde pública e governos para garantir que os candidatos promissores para vacinas em estágio avançado possam ser fabricados em quantidades suficientes e fornecidos equitativamente a todas as áreas afetadas, particularmente em regiões de pouco recursos. O CEPI emitiu recentemente um pedido de financiamento para apoiar os esforços globais de desenvolvimento de vacinas COVID-19, guiados por três imperativos: velocidade, fabricação e implantação em escala e acesso global. Mantemos uma abordagem dinâmica de gerenciamento de portfólio e disponibilizamos nossos recursos científicos facilitadores globalmente. Instamos a comunidade global de vacinas a mobilizar coletivamente o apoio técnico e financeiro necessário para enfrentar com êxito a pandemia da COVID-19 por meio de um programa global de vacinação e fornecer uma base sólida para combater futuras pandemias.