O uso de antibióticos nos últimos 80 anos tem salvado milhões de vidas e pode ser considerado um dos maiores avanços tecnológicos da humanidade. No entanto, a emergência de populações bacterianas resistentes aos tratamentos antimicrobianos tem se tornado uma preocupação para a comunidade científica e se configurou um verdadeiro desafio a ser superado. A incidência de novas infecções resistentes já superou em muito o desenvolvimento de novas drogas.
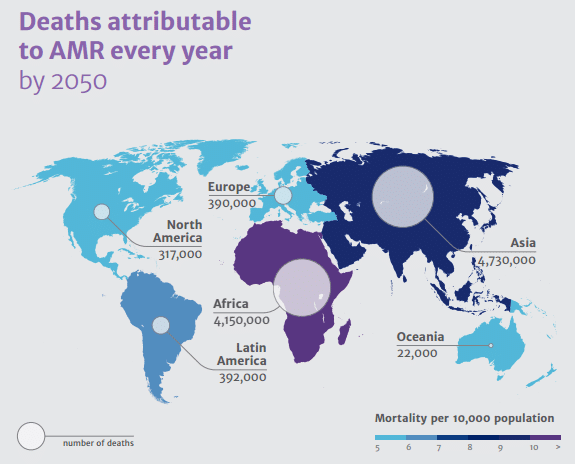
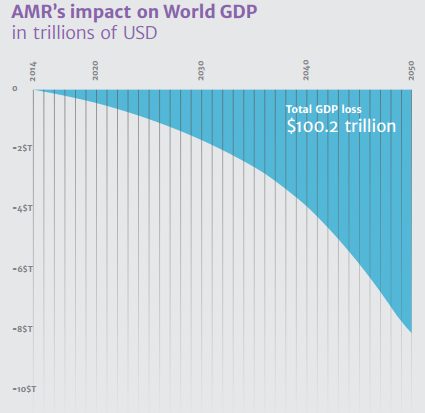
Em 2014 foi realizado um estudo encomendado pelo governo britânico intitulado Review on Antimicrobial Resistance [1] que estimou que patógenos resistentes causaram cerca de 50 mil mortes na Europa e nos Estados Unidos em 2015. Fez também uma projeção indicando que, em 2050, haverá um total de 10 milhões mortes por ano no mundo inteiro relacionadas a essas infecções. Todo esse cenário indica que a humanidade está se aproximando do fim da Era dos Antibióticos.
Todos os numerosos estudos epidemiológicos encaminham a comunidade internacional a um estado de alerta. A emergência de Infecções Resistentes a Antibióticos (ARI) tem gerado uma preocupação crescente com os efeitos na saúde pública e os impactos na economia dos países. Esse mesmo Review aponta nos seus cálculos que em 2050 terá sido acumulado um montante estimado em 100,2 trilhões de dólares em prejuízo à economia causado pelas ARIs (nesse montante estão inclusos todos os gastos com tratamento e prevenção, tempo de ociosidade dos trabalhadores enquanto enfermos e a própria morte dos infectados).
Todo esse contexto justifica a pressa e os enormes esforços direcionados para a descoberta e o desenvolvimento de novas estratégias de combater infecções que sejam menos eficientes do que os antibióticos em selecionar organismos mutantes. As atenções estão todas voltadas para novas abordagens e novas formas solucionar esse mesmo problema.
Microbiota
Ao tentar reproduzir uma doença humana em ratos uma equipe do Departamento de Veterinária e Ciências Biomédicas da Universidade da Pensilvânia – EUA acabou por descobrir que as bactérias que residem no corpo dos ratos possuem um papel de suma importância no combate de infecções [2].
Os pesquisadores tentaram inocular bactérias da espécie Bordetella pertussis (agente causador da Coqueluche, extremamente contagiosa em humanos) no trato respiratório de ratos e observaram que a infecção não se instalava adequadamente. Era necessária uma grande quantidade de unidades infectantes para que a infecção se instalasse e mesmo assim apenas no trato respiratório baixo, pois curiosamente, na cavidade nasal, as bactérias morriam logo após a inoculação nos ratos.
Eles, então, levantaram a hipótese de que havia bactérias no trato respiratório dos ratos que competiam exclusivamente com a B. Pertussis e impediam a sua proliferação no organismo. Essa suposição foi confirmada por dois experimentos simples: tratando previamente os ratos com antibióticos que destruíssem a sua microbiota, isso fez com que a infecção se instalasse mais facilmente; e inoculando outra espécie de bactéria de um mesmo gênero que a B. Pertussis (B. bronchiseptica), isso mostrou que esse outro patógeno conseguia se instalar facilmente.
Vários outros experimentos se seguiram a esse e levaram a comunidade científica a assumir com certo grau de certeza que os micro-organismos que se encontram em comensalismo e mutualismo com mamíferos desempenham um papel muito importante em resistir a infecções e modular a atividade imunológica dos hospedeiros [3]. Dessa forma, foi encontrada uma nova possibilidade de atuação para se combater infecções, dessa vez utilizando recursos que já existiam no nosso próprio corpo.
Muitas ideias surgiram a partir disso, elas vão desde transplantes fecais para reestabelecimento da flora intestinal até o uso de engenharia genética para transforma-la numa verdadeira sentinela pronta para proteger o hospedeiro contra infecções.
Os Bacteriófagos
Talvez a mais genial de todas essas novas ideias seja a terapia com fagos. Os bacteriófagos são vírus que infectam especificamente bactérias; injetam o seu material genético em seu interior, incorporando-o ao material genético do próprio hospedeiro e utiliza a sua maquinaria molecular para criar cópias de si mesmo. E qual a relação disso com a microbiota humana e as infecções bacterianas?
Uma vez que os bacteriófagos infectam as bactérias de forma específica, através de reconhecimento de proteínas de membrana, é viável utiliza-los no combate preciso a bactérias patogênicas. Usando a engenharia genética é possível fazer com que os fagos reconheçam apenas uma bactéria invasora específica e dizime sua população. Ou, de forma mais inteligente, é perfeitamente possível usá-los para modular as populações de bactérias que normalmente residem no corpo humano. Isso já foi feito por James J. Collins e sua equipe da Harvard-MIT Division of Health Sciences and Technology.
Eles conseguiram editar o genoma de uma espécie de bacteriófago (T7 phage) para que este carregue um gene que codifica uma enzima que degrada os biofilmes bacterianos. Ou seja, uma vez dentro da célula procariótica, os genes editados serão expressos e as bactérias residentes no intestino humano passarão a produzir constantemente essa enzima, impedindo o estabelecimento de bactérias que necessitam do biofilme para sobreviver e exercer sua patogênese [4].
Em seu artigo “The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation” Amy Langdon ainda levantou de forma um tanto quanto otimista a hipótese de que as primeiras infecções que possivelmente seriam passíveis de serem tratadas com esse tipo de terapia seriam as causadas por Mycobacterium tuberculosis, V. cholerae, C. difficile e E.coli.
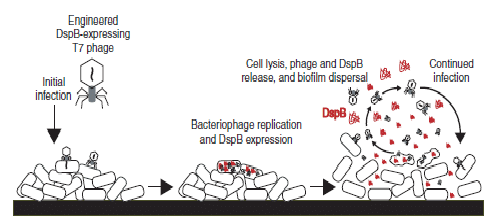
Além da alta especificidade, outro fator que contribui para o sucesso da terapia com fagos é a autorreplicação desses vírus. Por ser o que são os bacteriófagos conseguem se replicar espontaneamente numa taxa altíssima, o que reduz significativamente os custos de produção para essa terapia. Essa autorreplicação também torna o fago perfeitamente capaz de coevoluir com as bactérias e contornar o problema que é a seleção de hospedeiros mutantes que seriam imunes à ação do vírus [3]. Dessa forma, o uso de fagos é uma alternativa terapêutica pouco dispendiosa, evolutivamente robusta e bastante eficaz.
O uso contínuo de antibióticos tem moldado as populações de bactérias, tanto as patogênicas que sofrem pressão evolutiva quanto as da microbiota normal que, por serem mortas por essas drogas, acabam por deixar o indivíduo exposto a infecções que não ocorreriam caso as populações bacterianas simbióticas fossem completamente funcionais.
Voltando às previsões otimistas de Amy Langdon, no futuro espera-se que as características únicas da microbiota de cada indivíduo tenham um papel essencial no desenho terapêutico e que as opções de combate a infecções sejam “à prova da evolução” em que serão usados “remédios vivos e inteligentes” que percebem e combatem as doenças com o mínimo de intervenção médica por meio de substancias químicas. O avanço coletivo da compreensão de como o microbioma funciona e se relaciona com patógenos e hospedeiros está levando a um caminho sem volta para uma Era Pós-Antibióticos.
Referências Bibliográficas:
- Review on Antimibrobial Resistance. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. 2014:http://amrreview.org/sites/default/files/AMR%20Review%20Paper%20%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf
- Resident Microbiota Affect Bordetella pertussis Infectious Dose and Host Specificity – Laura S. Weyrich, Heather A. Feaga, Jihye Park, Sarah J. Muse, Chetan Y. Safi, Olivier Y. Rolin, Sarah E. Young, and Eric T. Harvill
- The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation. – Amy Langdon, Nathan Crook and Gautam Dantas
- Dispersing biofilms with engineered enzymatic bacteriophage – James J. Collins; Timothy K. Lu
Fonte das imagens:
http://milkiseki.jp/microbioma-humano/
http://scienceblogs.com.br/meiodecultura/tag/bacteriofagos/