Por Felipe Nogueira
Publicado na Skeptical Inquirer
Outubro Rosa e Novembro Azul são campanhas de conscientização dos cânceres de mama e próstata, respectivamente. No Brasil e em outros países, a população é incentivada a realizar exames como o PSA para o câncer de próstata e mamografia para o câncer de mama.
A principal ideia é o rastreamento (screening): fazer exames em pessoas assintomáticas, com objetivo de detectar a doença antes dos sintomas aparecerem e, com isso, aumentar as chances de cura e até oferecer um tratamento menos agressivo. Um bom exemplo é o rastreamento do câncer de colo de útero, onde a incidência de casos avançados diminuiu depois que o exame Papanicolau foi iniciado (Adegoke et al. 2012). Entretanto, estudos que analisam a eficácia do rastreamento dos cânceres de próstata e mama mostram que a realidade não é tão simples como divulgada nessas campanhas.
Em Maio de 2018, a Força-Tarefa de Serviços Preventivos dos Estados Unidos (USPSTF) revisou os estudos de rastreamento do câncer de próstata com PSA (Fenton et al. 2018). Apenas dois estudos randomizados controlados tiveram qualidade suficiente para avaliar o impacto do PSA na mortalidade. Um deles chamado de PLCO1 não mostrou diferença na mortalidade. O segundo estudo, chamado ERSPC2, mostrou que o rastreamento reduziu a mortalidade do câncer de próstata em homens entre 55-69 anos. Mas ainda assim não é tão simples. Para evitar uma morte por câncer de próstata e três casos de câncer de próstata com metástase, 1000 homens entre 55-69 anos precisaram ser rastreados a cada quatros anos durante 13 anos. Dos 1000, 27 homens receberam tratamento — cirurgia para remoção da próstata e/ou radiação. Mais importante, a maioria dos homens tratados, 24 pacientes, recebeu tratamento agressivo sem nenhum benefício, apenas danos causados pelo próprio tratamento. Independente de terem feito rastreamento, cinco homens morreram de câncer de próstata. Veja a Tabela 1 para as estimativas completas.

Uma análise criteriosa do rastreamento tem de considerar os danos causados pelo tratamento. A revisão da USPSTF encontrou que, daqueles que fazem cirurgia para remoção completa da próstata, um em cinco homens desenvolve incontinência urinária e dois a cada três homens têm impotência. Mais da metade daqueles que recebem radiação desenvolve impotência e um em seis desenvolve sintomas intestinais, incluindo urgência e incontinência fecal (Fenton et al. 2018).
A visão geral de que o rastreamento do câncer de próstata pode fazer mais mal do que bem é longe de ser novidade. Uma meta-análise de 2013 da Cochrane (Ilic et al. 2013) de cinco estudos não mostrou redução na mortalidade. Em 2012, a USPSTF tinha recomendado contra o rastreamento independente da idade. Atualmente, a USPSTF conclui que os benefícios e malefícios do rastreamento para homens com 55-69 anos são balanceados, recomendando uma decisão individual após uma consideração cuidadosa dos potenciais benefícios e danos. Para homens com 70 anos ou mais, a USPSTF recomenda contra o rastreamento. Veja o link para a Figura de apoio à decisão da USPSTF.
Em relação ao câncer de mama, a evidência parece um pouco mais favorável ao rastreamento, mas não de forma tão clara como as mensagens das campanhas sugerem. Um artigo publicado no JAMA em 2018 (Keating e Pace 2018) estimou que 10 em 10 mil mulheres nos seus cinquenta anos rastreadas anualmente durante dez anos evitariam morte por câncer de mama. Em contrapartida, 940 mulheres seriam submetidas a biópsias desnecessárias e 44 seriam tratadas desnecessariamente com cirurgia, radiação, quimioterapia, ou terapia hormonal. Independente do rastreamento, 62 mulheres ainda morreriam de câncer de mama. Como o tratamento para câncer de mama melhorou muito desde que os estudos foram conduzidos, o benefício do rastreamento pode ainda ser menor do que o reportado (Keating e Pace 2018). Para oferecer benefícios e reduzir os danos, a USPSTF recomenda mamografia apenas a cada dois anos e recomenda contra ensinar o auto-exame da mama.
Essa complexidade não está restrita ao câncer de próstata e mama. Entre 1975 e 2009, a incidência de câncer de tireoide praticamente triplicou nos Estados Unidos; de 4,9 para 14,4 em cada 100 mil pessoas. No entanto, a mortalidade continuou constante: 0,56 a cada 100 mil pessoas (Esserman et al. 2014). Já um estudo finlandês mostrou que, em 36% dos participantes sem qualquer sinal de doença na tireoide, pelo menos um nódulo do tipo mais brando na tireoide foi detectado na autópsia (Esserman et al. 2014).
Estudos de autópsia da próstata em homens que morreram por outras causas também mostram um grande “reservatório” de câncer. Em homens autopsiados entre 60-79 anos, a incidência de câncer de próstata variou entre 14 e 77%. Surpreendentemente, câncer de próstata foi encontrado até em homens autopsiados em seus vinte anos de idade, com uma incidência de 8-11% (Sandhu e Adriole 2012).
O que esses dados estão descrevendo é chamado sobrediagnóstico (Welch e Black 2010; Carter e Barrat 2017). O rastreamento detecta principalmente casos de câncer não letais ou indolentes — se não fosse pelo rastreamento, morreríamos com esses cânceres sem nem termos conhecimento que tínhamos a doença.
Sobrediagnóstico não é um resultado falso-positivo, onde após um teste positivo a avaliação subsequente não detecta sinais de câncer. No sobrediagnóstico, a lesão detectada de fato preenche os critérios de diagnóstico para câncer, mas não teria causado sintomas (por exemplo, não teria sido diagnosticado na ausência de rastreamento) (Welch e Black 2010; Carter e Barrat 2017).
O sobrediagnóstico e sua consequência são os principais danos do rastreamento. Uma vez que no momento do diagnóstico é impossível diferenciar lesões indolentes das letais, quase todos os casos são tratados (Welch e Black 2010). Estimativas sugerem que entre 20 e 60% dos cânceres de próstata detectados por rastreamento foram sobrediagnosticados (Fenton et al. 2018; Carter et al. 2015). Dos cânceres de mama detectados por rastreamento, a estimativa de sobrediagnóstico obtida pelos estudos randomizados é 19% (Keating e Pace 2018), enquanto uma análise de programas de rastreamento reportou 52% (Jørgensen e Gøtzsche 2009). Então, alguns podem se beneficiar do rastreamento do câncer de próstata e mama, porém mais pacientes lidam com danos de um tratamento agressivo que eles nem sequer precisavam.
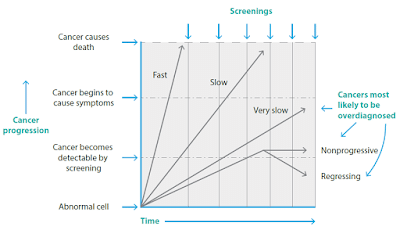
Uma das premissas do rastreamento é que o câncer tem uma progressão linear, que sempre permite detecção antes de ser letal. Mas essa premissa está desatualizada. O câncer é uma doença heterogênea, com diferentes taxas de progressão (Figura 1) (Carter e Barrat 2017). É mais provável que o rastreamento detecte os casos de câncer que crescem devagar ou que teriam regredido. Criticamente, os mais letais, aqueles que crescem rápido, são menos prováveis de serem detectados pelo rastreamento, uma vez que eles tendem a causar sintomas no intervalo entre exames de rastreamento (Carter e Barrat 2017).
Enquanto que as mensagens encorajando o rastreamento raramente mencionam sobrediagnóstico, elas frequentemente trazem afirmações como “se o câncer for diagnosticado precocemente, a chance de cura é 95%, mas cai para 20% se for diagnosticado em estágios avançados”. Entretanto, quando há sobrediagnóstico, a proporção de pacientes curados fica enviesada, uma vez que o número de pacientes que sobreviveram vai aumentar “automaticamente”, porque esses pacientes com esses casos não fatais são classificados como “curados”, mesmo quando o rastreamento não oferece nenhum benefício. Ironicamente, o aumento da incidência e taxas infladas de cura devido ao sobrediagnóstico podem aumentar os esforços para fazer rastreamento, levando a mais sobrediagnóstico3 (Brodersen et al. 2018).
Outra maneira que a estatística de sobrevivência fica enviesada está relacionada com quanto tempo o paciente vive após o diagnóstico. O rastreamento só é eficaz se conseguir detectar doença precocemente. Considere, por exemplo, que sem rastreamento, pacientes são diagnosticados pelos sintomas aos 70 anos e morrem aos 75 anos. Agora, considere que esses pacientes seriam diagnosticados por rastreamento aos 65 anos e morreriam pelo câncer dez anos depois. Com essas descrições, o rastreamento parece ser benéfico, já que quem faz rastreamento tem sobrevida de 10 anos, enquanto que sobrevive 5 anos após o diagnóstico. Em ambos os casos, os pacientes morreram com a mesma idade; o rastreamento apenas antecipou o diagnóstico, sem prolongar a vida. Isso é chamado de viés do tempo ganho (lead time bias) (Raffle e Gray 2007).
Devido a vieses, a estatística de sobrevivência (ou sobrevida) não mostra a eficácia do rastreamento. Se rastreamento é eficaz, a incidência de casos avançados tem de cair. Após a introdução de rastreamento dos cânceres de próstata e mama, é esperado um aumento da incidência de casos iniciais dessas doenças. Isso deve ser seguido, à medida que a população envelhece, por um declínio compensatório em casos avançados, enquanto a incidência geral permanece igual (Esserman et al. 2009). Note na Figura 2 que a incidência de casos iniciais de câncer de mama aumentou significativamente, enquanto que a incidência de casos regionais caiu bem pouco e a taxa de metástases para outras partes do corpo permaneceu estável. Curiosamente, apesar da mortalidade do câncer de mama estar caindo, o declínio foi maior em mulheres jovens não convidadas para o rastreamento (Gøtzsche et al. 2012; Narod et al. 2015). Além disso, a mortalidade do câncer de mama caiu de forma parecida em todos os lugares do mundo, mas o inicio do rastreamento difere entre os países (Gøtzsche 2015a). Observações semelhantes podem ser feitas sobre o câncer de próstata. Após o rastreamento, não houve um declínio significativo da mortalidade como esperado, e diferentes taxas do uso de rastreamento e tratamento não relacionam com a mortalidade do câncer de próstata (Esserman et al. 2009). Essas análises temporais, embora não demonstrem causalidade, indicam que o rastreamento leva a considerável sobrediagnóstico de casos iniciais e seu impacto na mortalidade no melhor caso é pequeno.

A melhor maneira para avaliar a eficácia do rastreamento é usando ensaios clínicos randomizados, como PLCO e ERSPC. Estudos clínicos comparam o grupo rastreado com um grupo controle, procurando por uma redução das mortes causadas pelo câncer sendo rastreado — o que é chamado de mortalidade específica do câncer. É, por exemplo, a redução na mortalidade do câncer de mama que leva a afirmação que o rastreamento com mamografia “salva vidas”. Porém, como as mulheres sobrediagnosticadas com câncer de mama podem receber radioterapia, que aumenta mortalidade devido a câncer de pulmão (Gøtzsche 2015b), o rastreamento pode causar mais mortes do que mortes evitadas devido ao câncer de mama. Uma vez que as mortes de tratamento são usualmente classificadas como outras causas, a mortalidade especifica do câncer é enviesada a favor do rastreamento. Esse viés é evitado usando a mortalidade geral. O que pode ser assustador é que os estudos clínicos de rastreamento não mostram redução na mortalidade geral. Como Vinay Prasad e coautores escreveram no BMJ, “nunca foi demonstrado que o rastreamento do câncer salva vidas”4. O rastreamento aumenta as mortes por outras causas? Não sabemos ainda – pode ser apenas “chance”, uma vez que milhões de pessoas seriam necessárias em um estudo clínico para detectar diferença na mortalidade geral. Prasad e coautores acreditam que esses grandes ensaios clínicos são necessários para conhecermos os efeitos do rastreamento. Em contraste, o pesquisador Peter Gøtzsche acredita que fazer tais estudos não é ético, já que muitas pessoas teriam de ser rastreadas sem sabermos se isso prolongaria as suas vidas, enquanto que os faria mais infelizes devido a estresse psicológico causados por falso-positivos e sobrediagnósticos. Devido a pequeno, se algum, beneficio na mortalidade, mas danos documentados, Gøtzche afirmou que o rastreamento com mamografia teria sido retirado do mercado, se fosse um medicamento (Gøtzsche 2015b).
Outros pesquisadores, como a Laura Esserman, acreditam que devemos focar em melhorar o rastreamento. Por exemplo, ela e coautores sugerem não chamar tais casos indolentes usualmente detectados por rastreamento de “câncer” (Esserman et al. 2009) Uma vez que, na cabeça de médicos e pacientes, um diagnóstico de câncer é associado com uma doença letal que causa sofrimento, renomear tais casos para lesões indolentes pode reduzir tratamento desnecessário. Isso foi proposto pela primeira vez pelo menos há dez anos, mas em Agosto de 2018 outros cientistas ainda estão pedindo por essas mudanças (Nickel et al. 2018). Esserman também propôs focar em um rastreamento baseado no risco, que foca em pessoas com alto risco de câncer. Testar se o rastreamento baseado em risco pode reduzir o uso da mamografia sem aumentar casos avançados é o objetivo do estudo Wisdom (Esserman et al. 2017).
Enquanto isso, o publico precisa ser informado adequadamente. As campanhas de conscientização precisam ser usadas para informar a população as complexidades do rastreamento. Isso é bem importante. De acordo com pesquisas de opinião, mulheres superestimam os benefícios da mamografia por um fator entre 10 e 200 (Wegwarth e Gigerenzer 2018). Além disso, como o rastreamento é frequentemente promovido como prevenção, 68% das mulheres em uma pesquisa de opinião acreditaram erradamente que mamografia reduz as chances de desenvolver câncer de mama. (Domenighetti et al 2003 Como um artigo de perspectiva no New England Journal of Medicine colocou, “Como as mulheres podem fazer uma decisão informada se elas superestimam o beneficio da mamografia tão grosseiramente?” Isso pode ser explicado pela falha dos médicos em comunicar os riscos do rastreamento: em uma pesquisa de opinião com 300 pacientes de rastreamento nos Estados Unidos, 90% deles não receberam informação do seu médico sobre os possíveis danos do rastreamento (Wegwarth e Gigerenzer 2018).
Essa não é a história completa. Uma revisão sistemática mostrou que médicos usualmente superestimam os benefícios do rastreamento e tratamento enquanto que subestimam seus danos. Uma pesquisa de opinião com médicos dos Estados Unidos sugeriu que médicos não compreendem as estatísticas do rastreamento: 76% dos médicos participantes foram enganados pela métrica de sobrevida discutida anteriormente (Wegwarth et al. 2012). Eles equivocadamente pensaram que pacientes diagnosticados por rastreamento com melhores taxas de sobrevida (5 após o diagnóstico) do que pacientes diagnosticados por sintomas significa que o rastreamento salvou vidas. Em um artigo, Wegwarth e Gigerenzer (2018) perguntaram “Por que o conhecimento do risco é tão escasso na saúde?” Os autores discutiram como a dificuldade de entender os riscos e benefícios na saúde provavelmente se deve como a informação estatística é apresentada, em artigos enviesados em períodos médicos e até o uso do risco relativo e estatística enganadora pela mídia. E pesquisas mostram como ferramentas elaboradas para auxiliar a decisão ajudam os pacientes a ficarem mais informados em relação ao rastreamento. Os pesquisadores concluíram perfeitamente: “Uma crítica massa de cidadãos informados não irá resolver todos os problemas na saúde, mas pode constituir um grande gatilho para uma melhor saúde” (Wegwarth e Gigerenzer 2018).
Notas
- PLCO: Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial
- ERSPC: European Randomized Study of Screening for Prostate Cancer
- Isso foi chamado do paradoxo da popularidade: “Quanto maior o dano pelo sobrediagnóstico e sobretratamento gerado pelo rastreamento, mais pessoas acreditarão que devem a saúde, ou ate suas vidas, ao programa”. (Raffle e Grey 2007, 68).
- Um estudo clínico de 2011 de rastreamento com tomografia em fumantes reportou redução da mortalidade geral. Embora isso seja um caso de rastreamento em um grupo de alto risco, Prasad e coautores consideraram a melhor evidência para redução da mortalidade geral em um estudo de rastreamento do câncer. Entretanto, como discutido pelos autores, uma meta-análise de 2013 para USPSTF não demonstrou redução da mortalidade geral (Prasad et al. 2016).
Livros interessantes
- Overdiagnosed: Making People Sick in the Pursuit of Health de H. Gilbert Welch, Lisa Schwartz e Steve Woloshin (2012);
- Mammography Screening: Truth, Lies and Controversy de Peter C. Gøtzsche (2012).
Referências
- Adegoke, O., S. Kulasingam, and B. Virnig. 2012. Cervical cancer trends in the United States: a 35-year population-based analysis. Journal of Womens Health (Larchmt) 21(10):1031-7. doi: 10.1089/jwh.2011.3385.
- Biller-Andorno, N. 2014. Abolishing Mammography Screening Programs? A View from the Swiss Medical Board. New England Journal of Medicine 370(21): 1965-1967
- Brodersen, J., B.S. Kramer, H. Macdonald, et al. 2018. Focusing on overdiagnosis as a driver of too much medicine. BMJ 362:k3494. doi: 10.1136/bmj.k3494
- Carter, J.L., R.J. Colett, and R.P. Harri. 2015. Quantifying and monitoring overdiagnosis in cancer screening: a systematic review of methods. BMJ 350:g7773. doi: 10.1136/bmj.g7773
- Carter, S.M., and A. Barratt. 2017. What is overdiagnosis and why should we take it seriously in cancer screening? Public Health Research and Practice 27(3):e2731722. doi: https://doi.org/1017061/phrp2731722
- Domenighetti, G., B. D’Avanzo, M. Egger, et al. 2003. Women’s perception of the benefits of mammography screening: population-based survey in four countries. International Journal of Epidemiology 32:816-21
- Esserman, L.J., H. Anton-Culver, A. Borowsky, et al. 2017. The WISDOM Study: breaking the deadlock in the breast cancer screening debate. npj Breast Cancer 3:34. doi:10.1038/s41523-017-0035-5
- Esserman, L.J., I.M. Thompson, B. Reid, et al. 2014. Addressing overdiagnosis and overtreatment in cancer: a prescription for change. The Lancet Oncology 15: e234-e242. doi: 10.1016/S1470-2045(13)70598-9
- Esserman, L, Y. Shieh, and I. Thompsom. 2009. Rethinking screening for breast cancer and prostate cancer. JAMA 302(15):1685-92. doi: 10.1001/jama.2009.1498.
- Fenton, J.J., M.S. Weyrich, S. Durbin, et al. 2018. Prostate-specific antigen–based screening for prostate cancer: A systematic evidence review for the U.S. Preventive Services Task Force. Agency for Healthcare Research and Quality, Evidence Synthesis No. 154. AHRQ Publication No. 17-05229-EF-1.
- Gøtzsche, P.C. 2015a. Commentary: Screening: a seductive paradigm that has generally failed us. International Journal of Epidemiology 244(1): 278-80. doi: 10.1093/ije/dyu267.
- ———. 2015b. Mammography screening is harmful and should be abandoned. Journal of the Royal Society of Medicine 108(9): 341–345. doi:10.1177/0141076815602452
- Hoffman, T.C., and C. Del Mar. 2017. Clinicians’ expectations of the benefits and harms of Treatments, Screening, and Tests: A Systematic Review. JAMA Internal Medicine 177(3):407-419. doi: 10.1001/jamainternmed.2016.8254.
- Ilic, D., M.M. Neuberger, M. Djulbegovic, and P. Dahm. 2013. Screening for prostate cancer. Cochrane Database of Systematic Reviews, Issue 1. Art. No.: CD004720. doi: 10.1002/14651858.CD004720.pub3
- Jørgensen, K.J., and P.C. Gøtzsche. 2009. Overdiagnosis in publicly organised mammography screening programmes: systematic review of incidence trends. BMJ 339:b2587. doi: 10.1136/bmj.b2587
- Keating, N.L., and L.E. Pace. 2018. Breast cancer screening in 2018: time for shared decision making. JAMA. doi:10.1001/jama.2018.3388
- Narod, S.A., J. Iqbal, and A.B. Miller. 2015. Why have breast cancer mortality rates declined? Journal of Cancer Policy 5: 8-17 https://doi.org/10.1016/j.jcpo.2015.03.002
- Nickel, B., R. Moynihan, A. Barratt, et al. 2018. Renaming low risk conditions labelled as cancer. BMJ 362:k3322 doi: 10.1136/bmj.k3322
- Prasad, V., J. Lenzer, and D.H. Newman. 2016. Why cancer screening has never been shown to “save lives”—and what we can do about it. BMJ 352:h6080 doi: 10.1136/bmj.h6080
- Raffle, A.E., and J.A.M. Gray. 2007. Screening: evidence and practice. Oxford University Press. ISBN 978-0-19-921449-5
- Sandhu, G.S., and G.L Adriole. 2012. Overdiagnosis of prostate cancer. Journal of the National Cancer Institute Monographs (45):146–151
- Stacey, D., F. Légaré, K. Lewis, et al. 2014. Decision aids for people facing health treatment or screening decisions. Cochrane Database of Systematic Reviews CD001431.doi: 10.1002/14651858.CD001431.pub5
- Wegwarth, O., and G. Gigerenzer. 2018. The barrier to informed choice in cancer screening: Statistical Illiteracy in Physicians and Patients. Recent Results in Cancer Research 210: 207-221. doi: 10.1007/978-3-319-64310-6_13.
- Wegwarth, O., L.M. Schwartz, S. Woloshin, et al. 2012. Do physicians understand cancer screening statistics? A national survey of primary care physicians in the United States. Annals of Internal Medicine 156:340-9. doi: 10.7326/0003-4819-156-5-201203060-00005.
- Welch, H.G., and W.C. Black. 2010. Overdiagnosis in cancer. Journal of the National Cancer Institute 102:605–613