Decisão histórica poderá transformar o tratamento da doença falciforme e da —-talassemia da doença, mas a tecnologia é dispendiosa.
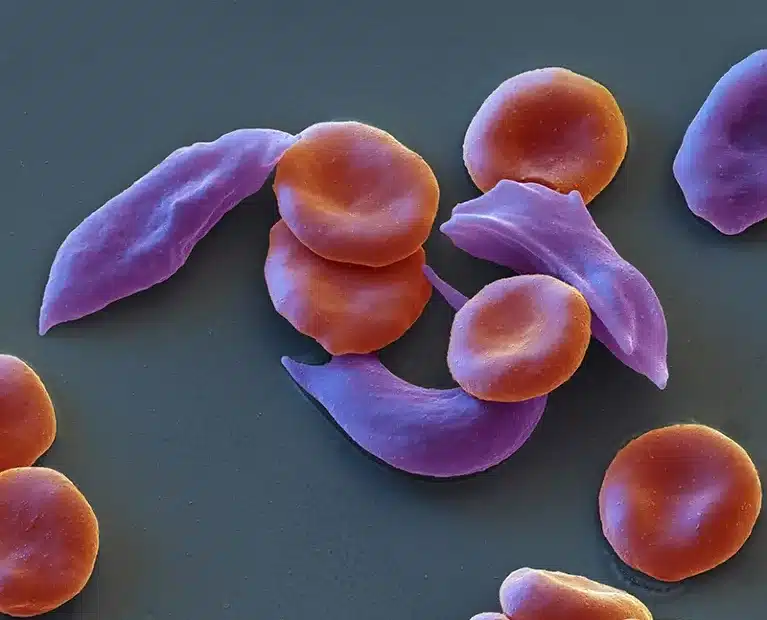
A anemia falciforme é marcada por glóbulos vermelhos deformados e pegajosos, afetando o fluxo sanguíneo.Crédito: Eye Of Science/SPL
Em primeiro lugar no mundo, o regulador de medicamentos do Reino Unido aprovou uma terapia que usa a edição genética CRISPR como tratamento para doenças. A decisão marca outro ponto alto para uma biotecnologia que tem sido regularmente elogiado como revolucionário na década desde a sua descoberta.
A terapia, chamada Casgevy, tratará as condições do sangue, doença falciforme e β-talassaemia. A doença falciforme, também conhecida como anemia falciforme, pode causar dor debilitante e as pessoas com talassemia podem necessitar de transfusões de sangue regulares.
“Esta é uma aprovação histórica que abre as portas para novas aplicações de terapias CRISPR no futuro para a potencial cura de muitas doenças genéticas”, disse Kay Davies, um geneticista da Universidade de Oxford, Reino Unido, em comentários ao Centro de Mídia Científica do Reino Unido.
Que pesquisa levou à aprovação?
A aprovação pela Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) segue resultados promissores de ensaios clínicos que testaram o tratamento único, administrado por infusão intravenosa e desenvolvido pela Vertex Pharmaceuticals em Boston, Massachusetts, e pela CRISPR Therapeutics em Zug, Suíça.
O estudo para doença falciforme seguiu 29 dos 45 participantes por tempo suficiente para obter resultados intermediários. Casgevy aliviou completamente 28 dessas pessoas de episódios debilitantes de dor por pelo menos um ano após o tratamento.
Os pesquisadores também testaram o tratamento para uma forma grave de talassemia, que é convencionalmente tratada com transfusões de sangue aproximadamente uma vez por mês. Neste estudo, 54 participantes receberam Casgevy e 42 pacientes participaram por tempo suficiente para fornecer resultados provisórios. Durante pelo menos um ano após o tratamento, 39 participantes, ou 93% dos tratados, não precisaram de uma transfusão de células vermelhas do sangue. As três pessoas restantes tiveram sua necessidade de transfusões de sangue reduzida em mais de 70%.
Como funciona a terapia genética?
A Casgevy conta com a ferramenta de edição de genes CRISPR, cujos desenvolvedores ganhou o Prêmio Nobel de Química em 2020.
A doença falciforme e a talassemia é causada por mutações na sequência de DNA de genes que codificam a hemoglobina, uma molécula que ajuda os glóbulos vermelhos a transportar oxigênio pelo corpo.
Na doença falciforme, a hemoglobina anormal torna as células sanguíneas deformadas e pegajosas, fazendo com que formem aglomerados que podem obstruir os vasos sanguíneos. Esses bloqueios reduzem o suprimento de oxigênio para os tecidos, o que pode causar períodos de dor intensa, conhecidos como crises de dor.
β-talassaemia ocorre quando mutações no gene da hemoglobina levam a níveis deficientes ou ausentes da molécula transportadora de oxigênio nos glóbulos vermelhos, baixo número de glóbulos vermelhos e sintomas como fadiga, falta de ar e batimentos cardíacos irregulares.
Os médicos administram Casgevy retirando células estaminais produtoras de sangue da medula óssea de pessoas com qualquer doença e utilizando CRISPR para editar genes que codificam para a hemoglobina nestas células. A ferramenta de edição de genes é uma molécula de RNA que guia a enzima para a região correta do DNA e uma enzima Cas9 que corta o DNA.
Uma vez que a enzima Cas9 atinge o gene alvo de Casgevy, chamado BCL11A, corta ambas as fitas de DNA. BCL11A impede geralmente a produção de uma forma de hemoglobina feita apenas em fetos. Ao interromper o BCL11A gene, Casgevy desencadeia a produção de hemoglobina fetal, que não carrega as mesmas anormalidades que a hemoglobina adulta em pessoas com células falciformes ou pacientes com β-talassaemia.
Antes que as células editadas por genes sejam infundidas de volta no corpo, as pessoas devem passar por um tratamento que prepare a medula óssea para receber as células editadas. Uma vez administradas, as células troncos dão origem a glóbulos vermelhos contendo hemoglobina fetal. Depois de algum tempo, isso alivia os sintomas, aumentando o suprimento de oxigênio para os tecidos. “Os doentes podem ter de passar pelo menos um mês numa instalação hospitalar enquanto as células tratadas se instalam na medula óssea e começam a produzir glóbulos vermelhos com a forma estável de hemoglobina”, o MHRA disse em um comunicado de imprensa.
Quão seguro é Casgevy?
Os participantes envolvidos nos ensaios, que estão em andamento, experimentaram efeitos colaterais, incluindo náusea, fadiga, febre e um risco aumentado de infecção, mas nenhuma preocupação significativa com a segurança foi identificada. O MHRA e o fabricante estão monitorando a segurança da tecnologia e divulgarão mais resultados.
Uma preocupação em torno da abordagem é que o CRISPR às vezes pode fazer modificações genéticas não intencionais com efeitos colaterais desconhecidos.
“É sabido que o CRISPR pode resultar em modificações genéticas espúrias, com consequências desconhecidas para as células tratadas” disse o geneticista David Rueda, do Imperial College London, ao SMC. “Seria essencial ver os dados de sequenciamento de genoma inteiro para essas células antes de chegar a uma conclusão. No entanto, este anúncio me faz sentir cautelosamente otimista.”
Outros países aprovarão os tratamentos?
A Food and Drug Administration dos EUA está considerando a aprovação de Casgevy, cujo nome genérico é exa-cel, para doença falciforme; é consultores se encontraram no mês passado discutir a terapia. A Agência Europeia de Medicamentos também está analisando o tratamento para ambas as doenças.
Por enquanto, é provável que a terapia continue sendo a reserva de nações ricas com sistemas de saúde desenvolvidos. “Este tratamento pode não ser facilmente ampliado para poder fornecer tratamentos em países de baixa e média renda, uma vez que requer a tecnologia para obter as células-tronco sanguíneas de um paciente, entregue o editor genético a essas células-tronco e, em seguida, a reinjeção dessas células, disse o geneticista” Simon Waddington, da University College London, ao SMC. “Não é um medicamento ‘fora da prateleira’ que pode ser prontamente injetado ou tomado em forma de pílula”, diz ele.
Quanto vai custar?
Mesmo em lugares onde ele ganha aprovação, o alto custo do Casgevy provavelmente limitará quem pode se beneficiar dele.
“O desafio é que estas terapias serão muito caras, pelo que uma forma de as tornar mais acessíveis globalmente é fundamental”, disse Davies.
O preço do tratamento ainda não foi estabelecido no Reino Unido, mas as estimativas sugerem que poderia custar cerca de US$2 milhões por paciente, de acordo com o preço de outras terapias genéticas.
“Não estabelecemos um preço de tabela para o Reino Unido neste momento e estamos focados em trabalhar com as autoridades de saúde para garantir o reembolso e o acesso aos doentes elegíveis o mais rapidamente possível,” um porta-voz da Vertex disse Nature.
doi: https://doi.org/10.1038/d41586-023-03590-6
Por Clarissa Wong
Publicado no Nature