Via Agência Fapesp
Pesquisadores do Instituto de Biociências da Universidade de São Paulo (IB-USP) estão estudando um grupo de genes humanos que, quando expressos em tumores malignos, conferem às células tumorais propriedades semelhantes às de células-tronco, tornando-as mais agressivas e resistentes ao tratamento.
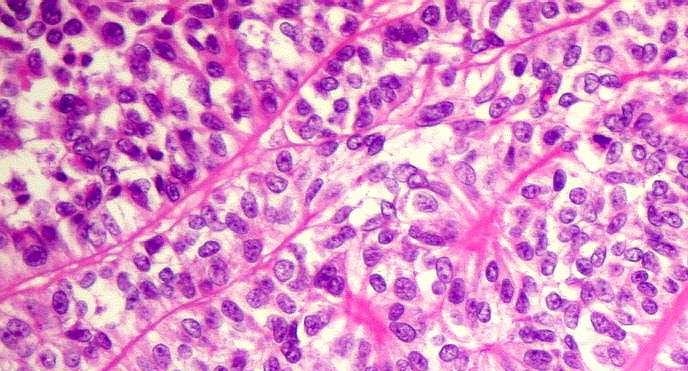
Experimentos in vitro foram feitos com linhagens de meduloblastoma, o tipo de câncer cerebral mais comum em crianças. Resultados recentes foram publicados nas revistas Stem Cells and Development e Cancer Science.
“Esses genes, quando expressos, não são simples marcadores de um pior prognóstico. Eles contribuem ativamente para a agressividade tumoral. São, portanto, alvos terapêuticos a serem explorados”, afirmou Oswaldo Keith Okamoto, professor do IB-USP e membro do Centro de Estudos do Genoma Humano e de Células-Tronco (CEHG-CEL), um dos Centros de Pesquisa, Inovação e Difusão (CEPIDs) apoiados pela FAPESP.
O grupo coordenado por Okamoto tem se dedicado a investigar o papel de quatro genes que codificam fatores relacionados à pluripotência: OCT4, L1TD1, LIN28 e miR-367. Este último, em vez de uma proteína, codifica um microRNA (pequeno pedaço de RNA que não contém informação para a produção de proteína mas tem papel regulatório no genoma).
De acordo com o pesquisador, esses quatro genes deveriam estar predominantemente expressos em células-tronco embrionárias existentes na primeira semana após a fecundação.
“Nesta fase, o embrião é formado por uma estrutura conhecida como blastocisto e, dentro dela, existe uma massa de células-tronco embrionárias que expressam fatores relacionados à pluripotência importantes para essa etapa do desenvolvimento”, explicou.
No entanto, análises de bancos de dados de expressão revelaram que esses mesmos genes frequentemente encontram-se expressos em amostras de meduloblastoma, conferindo às células tumorais algumas propriedades de células-tronco, como alta capacidade de autorrenovação (gerar novas células-tronco semelhantes) e de disseminação pelo corpo.
Estudos anteriores do grupo de Okamoto já haviam mostrado que a presença desse tipo de célula-tronco tumoral está correlacionada a uma menor sobrevida do paciente e a um maior risco de metástase.
“Diversos estudos foram feitos nos últimos 15 anos para compreender o papel dessas células-tronco tumorais, que já foram observadas em diversos tipos de câncer, entre eles mama e próstata. Elas são relevantes do ponto de vista clínico, pois são mais tumorigênicas, têm maior capacidade de autorrenovação, grande capacidade de se espalhar pelo corpo e colonizar sítios a distância e são mais resistentes ao tratamento”, disse Okamoto.
Segundo o pesquisador, ainda não se sabe ao certo como as células-tronco tumorais surgem. Existe a possibilidade de elas serem resultado da transformação maligna de uma célula-tronco normal. Outra hipótese é a de que uma célula já maligna ganhe novas alterações genéticas que lhe conferem características típicas de célula-tronco.
“Para alguns tumores de origem embrionária, como é o caso do meduloblastoma, acredita-se que ao longo do processo de maturação dos órgãos alguns genes que estão ativos nas células-tronco embrionárias e deveriam ser desligados ao longo do desenvolvimento do embrião, por algum motivo, não são. Isso impediria que essas células se diferenciassem de maneira adequada. Se elas se tornarem instáveis geneticamente, podem dar origem a um tumor. É uma hipótese plausível”, disse Okamoto.
Experimentos
Durante o pós-doutorado de Márcia Cristina Teixeira dos Santos, realizado com Bolsa da FAPESP, foi investigado mais profundamente o papel do gene L1TD1.
Usando uma técnica conhecida como RNA de interferência, que consiste em usar pequenas moléculas de RNA não codificadoras de proteínas capazes de se ligar ao RNA mensageiro do gene-alvo e interromper sua expressão, o grupo silenciou em duas linhagens de meduloblastoma o L1TD1 para ver se o procedimento afetava alguma propriedade importante para a agressividade tumoral.
Cerca de 48 horas após o silenciamento, sem qualquer outro tipo de intervenção, apenas 50% das células tumorais ainda permaneciam viáveis. Após 96 horas, cerca de 80% das células já estavam mortas.
A capacidade de migração e de invasão celular, essencial para a geração de metástase, caiu para menos da metade nesse período. Também foi observada redução nas taxas de proliferação e na resistência à morte por apoptose (uma espécie de suicídio celular).
Em outro ensaio, os pesquisadores observaram que o silenciamento do L1TD1 tornou as células tumorais mais sensíveis ao tratamento com quimioterápicos. Uma dose que normalmente seria suficiente para matar 40% das células em cultura conseguiu matar cerca de 70% após o procedimento.
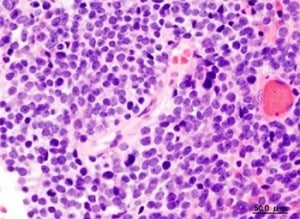
Na avaliação de Okamoto, porém, o resultado mais interessante foi o obtido no ensaio de geração de neuroesferas.
“Quando isolamos células-tronco neuronais normais e as cultivamos em laboratório, elas crescem formando estruturas conhecidas como neuroesferas. Normalmente, o mesmo acontece quando cultivamos as células-tronco tumorais de meduloblastoma. Mas, quando silenciamos o L1TD1, a capacidade de gerar as neuroesferas diminuiu cerca de 75%”, contou o pesquisador.
Estudos anteriores já haviam mostrado que, quanto maior é a capacidade de células tumorais gerarem neuroesferas, mais agressivo é o tumor e menor é a sobrevida do paciente.
“Observamos ainda que o silenciamento do gene diminuiu a expressão de proteínas que são marcadores típicos de células-tronco neuronais, como a CD133 e a nestina. Existe, portanto, uma correlação direta entre a expressão desse gene com a aquisição de propriedades típicas de células-tronco. Por inferência, acreditamos que esse gene é importante para a proliferação do tumor e para a resistência às drogas quimioterápicas”, disse Okamoto.
Em outro trabalho, realizado durante o mestrado de Carolini Kaid Dávila, também com apoio da FAPESP, o foco foi o microRNA miR-367. Mas desta vez, em vez de silenciar o gene, os pesquisadores induziram uma superexpressão.
“Nas linhagens de meduloblastoma com as quais trabalhamos, o miR-367 é pouco expresso. Silenciá-lo provavelmente não teria muito impacto. A superexpressão, por outro lado, ajuda a ressaltar seu efeito e torná-lo visível”, explicou Okamoto.
Para isso, o grupo injetou diretamente nas células tumorais moléculas de microRNA sintéticas que mimetizam a sequência de nucleotídeos encontrada no miR-367.
“Esse microRNA sintético tem a mesma sequência do original, mas algumas pequenas alterações químicas que tornam a molécula mais estável dentro da célula, então ela permanece tempo suficiente para observarmos o efeito”, explicou.
O método foi aplicado em quatro linhagens de meduloblastoma e em todas, em maior ou menor grau, foi observado aumento na proliferação e na capacidade de invasão de tecidos.
Para Okamoto, no entanto, o resultado mais significativo foi novamente a capacidade de geração de neuroesferas. “Variou de linhagem para linhagem, mas em alguns casos chegou a dobrar. Essas neuroesferas expressavam os marcadores típicos de células-tronco neuronais, como as proteínas CD133 e nestina”, disse.
O pesquisador ressalta que em nenhum dos trabalhos do grupo foi alterada a expressão de mais de um gene simultaneamente.
“Modificar a expressão de um único gene relacionado à pluripotência foi o suficiente para alterar significativamente o potencial agressivo do tumor. Portanto, acreditamos que interferir em L1TD1 ou qualquer outro desses seria uma boa estratégia para diminuir a resistência a drogas e inibir recidivas tumorais”, concluiu.
O artigo Embryonic Stem Cell-Related Protein L1TD1 Is Required for Cell Viability, Neurosphere Formation, and Chemoresistance in Medulloblastoma (DOI: 10.1089/scd.2015.0052) pode ser lido por assinantes da Stem Cells and Development aqui.
O artigo miR-367 promotes proliferation and stem-like traits in medulloblastoma cells (DOI: 10.1111/cas.12733), pode ser lido por assinantes da Cancer Science aqui.