O QUE É TERMODINÂMICA:
A Termodinâmica pode ser definida como a ciência da energia, o nome TERMODINÂMICA vem da palavra grega therme (calor) e dynamis (movimento), que descreve bem os primeiros esforços de se converter calor em trabalho.
A termodinâmica permite determinar a direção nas quais vários processos físicos e químicos irão ocorrer espontaneamente, e as condições para que possam ser revertidos (reversibilidade). Permite também determinar quais processos podem ocorrer, e quais não podem (irreversibilidade). Também permite determinar as inter-relações entre as diversas propriedades de uma substância, a exemplo calor específico, coeficiente de dilatação volumétrica, compressibilidade, e demais. Toda sua fundamentação e teorização são baseadas em três leis fundamentais, é de extrema importância à compreensão delas para o entendimento amplo do conhecimento. Mas antes de explica-las precisamos relembrar e aprender novos conceitos importantes para facilitar o estudo das leis.
ENERGIA: Definir energia é algo bastante complicado, certos autores acreditam não existir um conceito amplamente definido e independente. Entretanto “energia é algo que não se sabe bem o que ela é, mas se sabe muito bem o que ela não é”, é uma alusão aos infinitos significados são empregados pelo senso comum.
Aqui vão alguns conceitos.
- Em ciência, refere-se a uma das duas grandezas físicas necessárias à correta descrição do inter-relacionamento – sempre mútuo – entre dois entes ou sistemas físicos. A segunda grandeza é o momento. Os entes ou sistemas em interação trocam energia e momento, mas o fazem de forma que ambas as grandezas sempre obedeçam à respectiva lei de conservação.
- Energia é a grandeza física capaz de alterar a matéria, independente de sua propriedade física ou posição espacial.
- Energia é tudo aquilo que realiza trabalho ou realizar uma ação
- Energia é a quantidade de movimento molecular ou atômico.
- Energia é uma medida do nível de aleatoriedade da orientação dos vetores coordenado e momento de um sistema em equilíbrio termodinâmico.
Como podem notar o que mais existe são conceitos de energia, por isso friso que o que iremos trabalhar serão os conceitos voltado à termodinâmica.
Energia interna (U): é a energia presente em determinado sistema termodinâmico, existem dois níveis de energia interna, a Macroscópica e Microscópica.
- Nível macroscópico: é o nível de energia acessível aos nossos sentidos, como por exemplo, transferência de calor, onde conseguimos perceber se um objeto se encontra em um maior grau de temperatura apenas aproximando a nossa mão dele.
- Nível microscópico, inacessível aos nossos sentidos, podemos citar exemplos como as vibrações de um átomo de ouro, por exemplo, somente com aparelhos de medição precisas podemos avaliar o grau de energia de um sistema microscópico.
A energia pode se apresentar de várias formas, como energia cinética, energia térmica, energia sonora, energia nuclear, energia luminosa, energia mecânica, etc, depende do sistema termodinâmico que está sendo estudado.
Energia térmica: Uma das muitas forma que a energia se apresenta pra nós, está diretamente associada à temperatura interna de um sistema, ela se apresenta como a energia cinética média de cada uma das partículas do sistema a partir do seu cento de massa. Também conhecida como caloria (cal) ou vulgarmente conhecida como CALOR (Q), já saliento que a definição do senso comum em relacionar ambas é errado, uma vez que calor é a transferência de energia térmica de um determinado corpo a outro. Calor não é uma propriedade dos sistemas termodinâmicos, e por tal não é correto afirmar que um corpo possui mais calor que outro, e tampouco é correto afirmar que um corpo “possui” calor. Os corpos (ou sistemas) possuem energia interna, essa composta por duas parcelas, à energia térmica e a energia potencial (energia química). Os conceitos de energia interna ou mesmo de energia térmica não devem jamais ser confundidos com o conceito de calor; que implica sempre energia térmica em trânsito ou transferida devido a uma diferença de temperaturas.
Um processo onde não há interação do calor é chamada de processo adiabático presente somente em concepções ideais.
TEMPERATURA (T): Há muita confusão entre temperatura e calor mesmo ambas sendo intrinsecamente diferente, calor como já vimos é transição energia térmica de um corpo para outro, já a temperatura trata-se do grau de agitação das molécula. Temperatura em termodinâmica é sempre a absoluta, expressa na escala Kelvin.
- Temperatura: é uma grandeza física que mensura a energia cinética média de cada grau de liberdade de cada uma das partículas de um sistema em equilíbrio térmico. Em sistemas constituídos apenas por partículas idênticas essa definição associa-se diretamente à medida da energia cinética média por partícula do sistema em equilíbrio térmico.
- Temperatura é o grau de agitação das moléculas.
PRESSÃO (P): é a relação entre uma determinada força aplicada em certa área.
O termo pressão é utilizado em diversas áreas da ciência como uma grandeza escalar que mensura a ação de uma ou mais forças sobre um determinado espaço, podendo este ser líquido, gasoso ou mesmo sólido. A pressão é uma propriedade intrínseca a qualquer sistema, e pode ser favorável ou desfavorável para o homem: a pressão que um gás ou vapor exerce sobre a pá de uma hélice, por exemplo, pode ser convertida em trabalho. Uma turbina-vapor seria o melhor exemplo para explicar tal ação.
VOLUME (V): é a quantidade de espaço ocupado por um corpo.
TRABALHO (W): Em termodinâmica, Trabalho é tudo aquilo que tem como efeito sobre tudo aquilo que é externo ao sistema puder deslocar massa, ou seja, é uma medida de energia transferida pela aplicação de uma força ao longo de um deslocamento. Expressado pela fórmula.
O valor de W depende das interações que ocorrem entre o sistema e a vizinhança, durante o processo, e não apenas dos estados iniciais do sistema, portanto o trabalho não é uma propriedade do sistema ou da vizinhança. Porém em termodinâmica ele é expresso de várias outras maneiras, que iremos ver ao decorrer dessa apostila. A unidade de trabalho é Joule (J):
F é o vetor força
r é o vetor deslocamento.
POTENCIA: O trabalho realizado por unidade de tempo é conhecido como potencia, a unidade de potencia é KJ/s ou KW.
NOVOS CONCEITOS.
Sistemas: é tudo aquilo que desejamos estudar, pode ser simples como um sistema massa-mola ou um Ciclo Rankine. Podemos delimitar o que queremos estudar, desde uma parede fechada em que há variação de temperatura dela, ou a quantidade de matéria em um tanque. A composição da matéria pode ser fixa ou variar em função das reações químicas, físicas ou nucleares, a forma ou volume das reações que estão sendo analisadas não necessariamente constantes, no caso de um gás sendo comprimido em cilindro pistão ou o inflar de um balão. O sistema tem suas áreas tem suas restrições, denominadas de fronteira e vizinhança.
REFORÇANDO: Sistema é quantidade de matéria/energia ou região no espaço que desejamos estudar.
Fronteira: delimita até onde o sistema atua, ela pode estar em repouso ou em movimento.
Vizinhança: tudo que é externo ao sistema.
São graças à fronteira e vizinha que conseguimos delimitar os dois tipos de sistemas mais comuns em Termodinâmica que são os Sistemas Fechados e Sistemas Abertos.
Sistemas Fechados: também conhecido como sistema isolado, ele é definido quando a quantidade de matéria se mantem constante e não há fluxo de massa entre suas fronteiras. Ou seja, sua energia pode aumentar ou se mantendo constante.
Sistemas Abertos: nesse tipo de sistema fronteira e vizinhança se correlacionam, e há constante interação entre eles, o ocasiona a variação de matéria e de fluxo de massa.
Pontos de vistas: há duas formas de se avaliar um sistema, de uma visão macroscópica ou uma visão microscópica. Na visão macro temos a Termodinâmica Clássica, responsável por avaliar o sistemas de uma forma global e não se preocupa com o estudo da estrutura da matéria a níveis moleculares. Embora o comportamento do sistema molecular seja afetado a termodinâmica clássica permite que os consideremos depressíveis. Ela não pode ser aplicada a quaisquer sistemas, sendo importante avaliar bem o que se procura estudar. Já da termodinâmica que estuda o visão microscópica é conhecida como Termodinâmica Estatística, ela se preocupa diretamente com a estrutura da matéria, seu objetivo é avaliar por meios estáticos o comportamento médio das partículas que compõe o sistema de interesse e relacionar com o comportamento macroscópico observado do sistema.
Estado: refere-se à condição do sistema como descrito por suas propriedades, já que normalmente existem relações entre o sistema e suas propriedades. Com frequência o estado pode ser especificado junto com um subconjunto de propriedades e as demais propriedades sendo obtida através desse subconjunto.
Postulado de estado:
O estado de um sistema compressível simples é completamente especificado por duas propriedades intensivas independentes
Ou seja, um sistema só é chamado de sistema compressível simples quando não há interações de forças eletromagnéticas, gravitacionais, de movimento e tensões superficiais.
Processo: é a transformação de um estado para outro. Porém, se um sistema exibe o mesmo valor de suas propriedades em dois tempos distintos ele está no mesmo estado nesses tempos. Um sistema é tido em regime permanente se nenhuma de suas propriedades varia com o tempo.
Existem três tipos de processos: Isotérmico –temperatura constante – Isobárico – pressão constante – e Isocórico ou Isovolumétrico – pressão constante
Propriedade: é uma característica microscópica de um sistema, tal como massa, volume, energia, pressão e temperatura, para quais valores numéricos podem ser atribuídos em um dado tempo sem o conhecimento do comportamento prévio do sistema. Ou seja, uma grandeza é uma propriedade se, e somente se, sua mudança de valor entre dois estados é independente do processo. São classificadas em duas
Extensivas: se seu valor para o sistema como um todo é a soma de seus valores para as partes nas quais o sistema é divido. Massa e energia são exemplos, essas propriedades podem variar com o tempo.
Intensivas: Não são aditivas como a anterior. Seus valores são independentes do tamanho ou da extensão de um sistema, podem variar o local no decorrer do sistema, logo as propriedades intensivas podem ser funções do tempo e espaço enquanto as extensivas podem ser somente do tempo. Volume Específico, Pressão e Temperatura são exemplos de propriedades intensivas.
Equilíbrio: Em mecânica clássica para se notar o equilíbrio basta notar se todas as forças de um sistema exercem uma condição de estabilidade sobre um determinado objeto a ser estudado. Em termodinâmica, isso é mais abrangente, não incluindo somente equilíbrio de forças, mas também de propriedades, tais como temperatura e pressão se mantem com valores uniformes, vale ressaltar que não existe exigência que um sistema esteja em equilíbrio durante o processo somente se estabelece a relação de equilíbrio ao final do processo. Para muito desses processos estamos limitados ao conhecimento do estado antes de o processo ocorrer e do estado depois que o processo é completado.
Agora que já relembramos alguns conceitos e conhecemos novos, podemos seguir com o estudo das leis.
As Leis da Termodinâmica
Lei zero (Equilíbrio Termodinâmico)
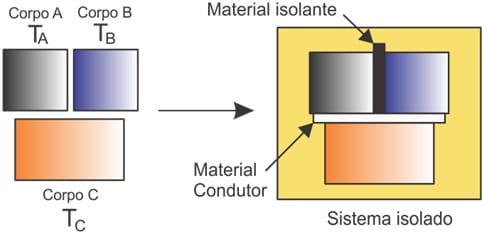
Diz que se dois corpos A e B em equilíbrio térmico, entre si e forem colocados em contato e entre eles esteja um corpo C em um sistema adequado, ao verificar -se experimentalmente não apenas A e B estarão em equilíbrio entre si, mas C também estará em equilíbrio com ambos os corpos.
Podemos expressar essa através do seguinte pensamento
Se dois corpos estão em equilíbrio térmico com um terceiro corpo, então eles devem estar em equilíbrio entre si.
Primeira Lei (Conservação de Energia) – ΔU
“Na natureza na se cria, nada se perde, tudo se transforma” – Antoine Lavoisier.
Está frase dita há mais de dois séculos explica de maneira simples e sucinta do que se trata a primeira lei. Que diz: ‘ a energia é uma propriedade termodinâmica e que jamais energia pode ser criada ou destruída, ela apenas muda de forma’. Um exemplo que gosto de usar é:
Imagine o seguinte sistema, um meteoro que está em percurso de colisão com a Terra, como já sabem ele deve esta a certa altura X a partir de um referencial vindo do solo. E toda a energia presente nesse meteoro à altura X é a energia potencial, porem a partir do momento em que ele começa a se aproximar do nosso planeta, essa energia é convertida em energia cinética, e assim que ele entra em colisão com o solo a sua energia vai ser convertida principalmente em energia sonora, energia térmica, e varias outras formas de energia.
Porem para nossos fins de estudos a primeira lei estabelece uma relação de entre calor e trabalho trocados entre um sistema e seu meio exterior no que se refere à variação da energia interna do sistema.
Considere um sistema e sua vizinhança, em uma situação tal que certa quantidade de calor Q tenha atravessado a fronteira comum aos dois (devido à diferença de temperaturas entre ambos). Considere também que a fronteira comum entre os sistemas se mova neste processo, implicando em energia trocada na forma de trabalho entre ambos. Neste caso a variação na energia interna do sistema em foco é expressa por:
A expressão acima representa analiticamente o primeiro princípio da termodinâmica, cujo enunciado pode ser:
A variação da energia interna de um sistema é igual à diferença entre o calor e o trabalho trocados pelo sistema com o meio exterior.
Analisando o princípio de conservação de energia no contexto termodinâmico.
Um sistema não pode criar ou consumir energia, apenas armazena-la ou transferi-la ao meio em que se encontra, como o trabalho, ou ambas as situações simultâneas, ou seja, a receber uma quantidade de Q de calor ela irá realizar um trabalho correspondente a quantidade de calor, assim aumentando a energia interna do sistema ΔU.
Segunda Lei (Entropia – S).
Peço para vocês se manterem bem atentos a essa parte, pois parte da minha explicação foi voltada mais a didatismo do que a conceitos científicos propriamente ditos, fiz isso para você conseguir enxergar como a Entropia se apresenta a nós, do que cientificamente ela realmente é.
Está lei é que mais se mostra presente no nosso dia a dia, e como energia ela possui vários conceitos. Com o passar do tempo o a energia do sistema vai se dissipando, ou seja, vai diminuído. Essa lei não tem axiomas matemáticos, ela é intrínseca à natureza, ao tentar refuta-la ou ao tentar prova-la, ela se mostra presente, por meios das irreversibilidades. Ela também define a capacidade de mudança de um sistema ou matéria.
Ela assim como energia é difícil de conceituar e possui várias definições que também são inerentes a cada área de estudo, antes de falar alguns conceitos gostaria de expressa-la através de uma didática.
Cubo de gelo: Imagine o sistema, um cubo de gelo em cima de uma mesa onde a temperatura do meio externo é de 30ºC, o cubo em seu estado atual (sólido) possui pouquíssima entropia, e como existe uma diferença de temperatura existe troca de calor entre o meio e o cubo de gelo, e como já vimos quando é troca de calor há ganho de energia. Com o passar do tempo o cubo vai derretendo e entrando em estado líquido até se torne totalmente líquido.
Agora vamos analisar o sistema por meio da segunda lei.
Quando se tem um sistema onde quase não se pode haver mudanças em suas propriedades esse sistemas tem um grau alto de “ordem”, no cubo de gelo por exemplo, as moléculas de água estão agrupadas em um determinado formato imutável, naquele momento, porém com o passar do tempo o cubo adquire energia calorífica e faz com que as moléculas se agitem mais, causando aumento de temperatura e consecutivamente ganho de energia, logo modifica a forma como as moléculas se ordenam, entrando em estado líquido o que consecutivamente aumenta a “desordem” do sistema.
Após esses exemplos podemos definir alguns conceitos a entropia.
- Entropia é o aumento de energia interna de um sistema.
- Entropia é o aumento de desordem de um sistema.
- Entropia estabelece, portanto uma seta para o tempo: estabelece em essência a possibilidade de se definir com precisão uma ordem cronológica para uma série de eventos relacionados. Estabelece que energia cinética macroscopicamente mensurável possa sempre reduzir-se, mediante trabalho, a calor, e desta forma acabar fazendo parte das entranhas de um sistema termodinâmico – ou seja, da energia interna deste – contudo o processo inverso jamais ocorre com rendimento de 100%. Calor oriundo da energia interna de um sistema não pode ser totalmente convertido em trabalho, e por tal jamais é completamente convertido em energia cinética macroscopicamente mensurável.
Porém duas definições são de melhor importância para nosso curso, são os enunciados de Clausius e Kelvin-Plack.
- Enunciado de Clausius:
O calor não pode fluir, de forma espontânea, de um corpo de temperatura menor, para outro corpo de temperatura mais alta.
Tendo como consequência que o sentido natural do fluxo de calor é da temperatura mais alta para a mais baixa, e que para que o fluxo seja inverso é necessário que um agente externo realize um trabalho sobre este sistema.
- Enunciado de Kelvin-Planck:
É impossível a construção de uma máquina que, operando em um ciclo termodinâmico, converta toda a quantidade de calor recebido em trabalho.
Este enunciado implica que, não é possível que um dispositivo térmico tenha um rendimento de 100%, ou seja, por menor que seja sempre há uma quantidade de calor que não se transforma em trabalho efetivo.
Bem, conseguimos aprender bastante por hoje, irei dar uma pausa para não ficar muito massivo pra vocês, enquanto isso aguardem o próximo texto sobre Ciclo Carnot, ele será de extrema importância para você que quer aprender um pouco mais sobre o tema, e vem com série de curiosidades a mais nele.