Por Michelle Starr
Publicado na ScienceAlert
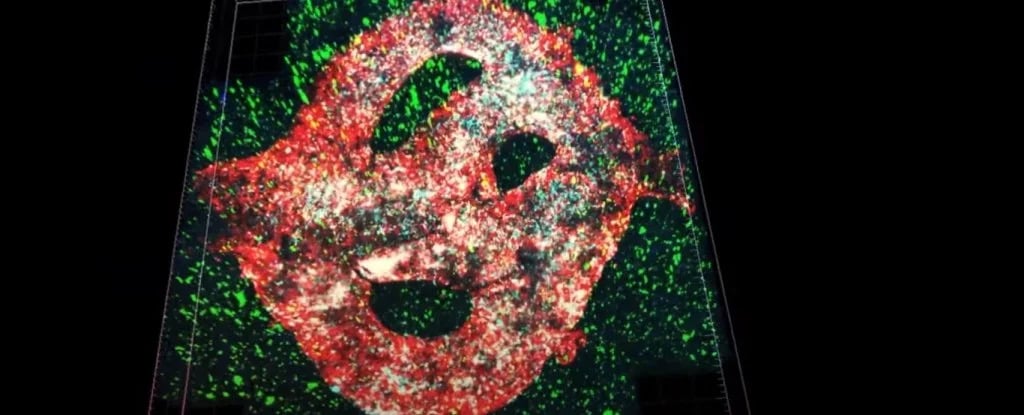
Pela primeira vez, uma das formas mais mortais de tumor cerebral foi bioimpressa com sucesso em 3D, resultando no modelo mais completo desenvolvido em laboratório até o momento.
Cientistas da Universidade de Tel Aviv imprimiram um glioblastoma em um ambiente semelhante ao do cérebro, incluindo vasos que fornecem sangue à massa. Esta é a replicação mais completa de um tumor e do tecido circundante – um avanço que pode ajudar a desenvolver tratamentos, disseram os pesquisadores.
O glioblastoma pode ser raro, mas é particularmente horrível. Ele cresce rápida e agressivamente no cérebro ou tronco cerebral, não pode ser curado e quase sempre é fatal.
Também é difícil de tratar. Como o câncer é tão agressivo, o tratamento precisa ser bastante rigoroso, geralmente exigindo diversas sessões de quimioterapia e radioterapia, onde os pacientes geralmente ficam doentes demais para concluí-las.
O tecido de glioblastoma, retirado e cultivado de tumores removidos de pacientes, é uma via pela qual os médicos esperam aprender mais sobre esse câncer diabólico. Isso geralmente é feito em placas de Petri e é uma ferramenta extremamente útil – mas tem limitações, disse o pesquisador de câncer e nanocientista Ronit Satchi-Fainaro, da Universidade de Tel Aviv.
Em um estudo anterior, ela e sua equipe descobriram uma proteína chamada P-selectina que é produzida quando células cancerosas no glioblastoma encontram células microgliais no cérebro – as células imunológicas mais proeminentes no sistema nervoso central.
Essa proteína aciona a micróglia para atuar em apoio ao glioblastoma, em vez de lutar contra ele – com resultados devastadores para a pessoa.
“No entanto, identificamos a proteína em tumores removidos durante a cirurgia, mas não em células de glioblastoma cultivadas em placas de petri de plástico 2D em nosso laboratório”, explicou ela.
“A razão é que o câncer, como todos os tecidos, se comporta de maneira muito diferente em uma superfície de plástico do que no corpo humano. Aproximadamente 90 por cento de todas as drogas experimentais falham no estágio clínico porque o sucesso alcançado no laboratório não é reproduzido nos pacientes”.
A tentativa da equipe de encontrar uma solução para essa limitação foi uma biotinta de glioblastoma, criada a partir de células de glioblastoma, astrócitos e micróglia derivada de um paciente. Usando uma biotinta removível revestida em tipos de células que formam os vasos sanguíneos, eles também conseguiram fornecer ao seu modelo um suprimento de sangue funcional.
Cada modelo de glioblastoma foi impresso em 3D em um biorreator em um hidrogel baseado em uma matriz extracelular também retirada do paciente.
O modelo de glioblastoma foi então conectado e veiculado com a matriz extracelular através dos vasos sanguíneos, para simular a maneira como os tumores interagem com o tecido cerebral circundante. Isso fornece uma maneira de estudar a forma como o câncer se comporta, de forma específica ao seu ambiente – o cérebro.
“As propriedades físicas e mecânicas do cérebro são diferentes das de outros órgãos, como pele, a mama ou os ossos”, disse Satchi-Fainaro.
“O tecido mamário consiste principalmente de gordura, o tecido ósseo é principalmente de cálcio; cada tecido tem suas próprias propriedades, que afetam o comportamento das células cancerígenas e como elas respondem aos medicamentos. Cultivar todos os tipos de câncer em superfícies de plástico idênticas não é uma simulação ideal do ambiente clínico”.
A equipe então testou seus modelos usando P-selectina. Um inibidor de P-selectina foi introduzido em culturas de glioblastoma cultivadas em placas de Petri, bem como em modelos impressos em 3D e modelos animais. Nas culturas de placa de Petri, nenhuma mudança foi observada no crescimento ou migração celular, em comparação com o grupo de controle não-tratado.
Para os modelos impressos em 3D e modelos animais, o inibidor de P-selectina resultou em uma taxa de crescimento mais lenta em comparação com os controles não tratados.
“Este experimento nos mostrou por que drogas potencialmente eficazes raramente chegam aos hospitais; simplesmente porque falham nos testes em modelos 2D e vice-versa: ou seja, drogas consideradas um sucesso fenomenal em laboratório, acabam falhando em ensaios clínicos”, disse Saitchi-Fainaro.
O sequenciamento genético e a taxa de crescimento dos tumores impressos em 3D também corresponderam mais de perto ao que a equipe observou em pacientes vivos. Em placas de petri 2D, as amostras mudam com o tempo para que não correspondam mais aos tumores dos pacientes, mas os glioblastomas impressos em 3D permaneceram semelhantes às amostras dos pacientes.
Além disso, todas as culturas 2D crescem na mesma taxa; enquanto os tumores impressos em 3D mostraram taxas de crescimento variáveis, que é o que é observado em humanos e animais.
Isso não apenas sugere uma maneira de estudar com mais precisão o comportamento do glioblastoma, mas também pode levar a formas de desenvolver intervenções específicas para o paciente.
“Se pegarmos uma amostra do tecido de um paciente, junto com sua matriz extracelular, podemos bioimprimir em 3D dessa amostra 100 tumores minúsculos e testar muitos medicamentos diferentes em várias combinações para descobrir o tratamento ideal para esse tumor específico”, explicou Saitchi-Fainaro.
“Mas talvez o aspecto mais empolgante seja encontrar novas proteínas-alvo e genes medicáveis em células cancerígenas – uma tarefa muito difícil quando o tumor está dentro do cérebro de um paciente humano ou modelo animal. […] Nossa inovação nos dá acesso sem precedentes, sem limites de tempo, a tumores em 3D que melhor mimetizam o cenário clínico, permitindo uma investigação ideal”.
A pesquisa foi publicada na Science Advances.