O uso extensivo de antibióticos desde a década de 40 do século XX possibilitou um aumento na taxa de sobrevivência às infecções bacterianas sem precedentes. Porém, com o aumento do número de casos de infecções por bactérias resistentes, ficou evidente que não será tão fácil combater organismos que passaram por um longuíssimo período (3,5 bilhões de anos) de seleção ao longo de sua história evolutiva, desde o surgimento dos primeiros procariotos até os dias atuais.
Como todo organismo vivo os patógenos são susceptíveis a adquirir variabilidade através de sucessivas mutações em seu material genético e transferir essas mudanças para as gerações posteriores. O uso de antibióticos completa o algoritmo necessário para que ocorra evolução (variabilidade + hereditariedade + seleção). Basta que surja um indivíduo mutante capaz de contornar o efeito do antibiótico. Uma alteração na permeabilidade da membrana ao antibiótico, uma enzima mutante capaz de degradar ou inativar o fármaco, qualquer pequena alteração fenotípica que confira vantagens será automaticamente selecionada e sua frequência na população aumentará até que a eficiência dos remédios utilizados seja nula.
Um estudo epidemiológico do Centro Europeu para o Controle de Doenças e da Agência Europeia de Medicina, permitiu que se estimasse o número assustador de 25 mil óbitos de pacientes infectados por bactérias multi resistentes por ano na União Europeia (*). Os Centros de Prevenção e Controle de Doenças (Centers of Disease Control and Prevention – CDC) avaliam que, nos Estados Unidos, 2 milhões de pessoas se infectam com cepas resistentes e 23 mil pessoas morrem a cada ano (**). Toda vez que se desenvolve uma nova droga ela se torna passível de se tornar obsoleta com o passar dos anos, e então a comunidade científica corre contra o tempo para desenvolver novas drogas que novamente contribuirão para o surgimento de populações resistentes. Estamos apostando corrida com a Evolução, e vamos perder a menos que encontremos outros caminhos.
Em meio a esse problema eis que Rolf Kümmerli, Ph.D. em Biologia Evolutiva, e sua equipe publicam um artigo intitulado Gallium-mediated siderophore quenching as an evolutionarily robust antibacterial treatment (***) no qual mostra uma alternativa no mínimo elegante e possivelmente uma solução para o problema. Dr. Kümmerli é um dos expoentes da Sociomicrobiologia, um novo campo de estudos voltado para investigar a forma como os micro-organismos interagem entre si, à procura de um “antibiótico definitivo”, “imune à Evolução”. Para tal é necessário procurar terapias em que as diferenças entre a resposta de um organismo resistente e um susceptível sejam minimizadas, dessa forma, mutações que conferem resistência são pouco prováveis de surgir e/ou de se espalhar na população.
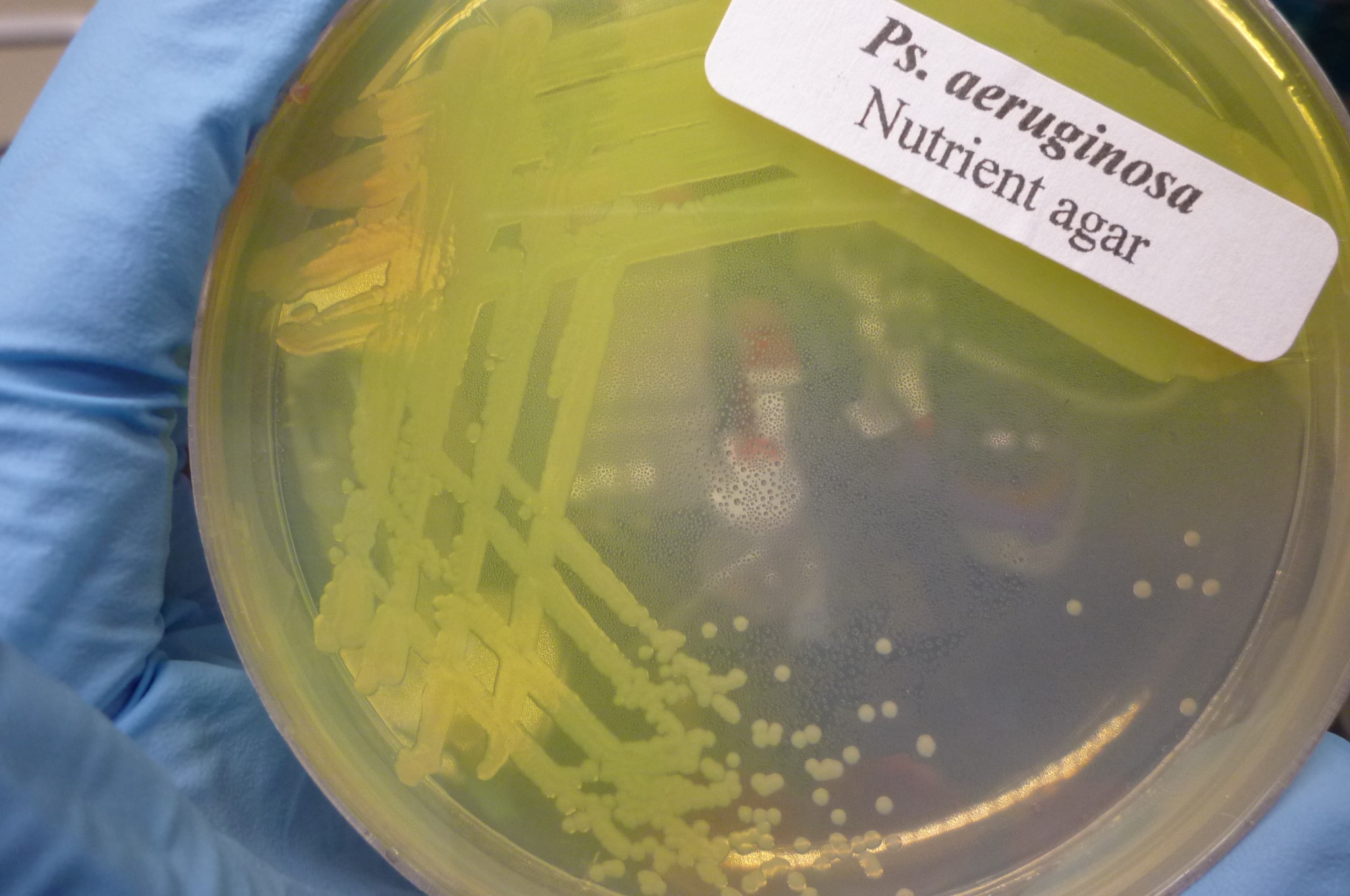
O experimento e Kümmerli partiu da constatação de que os micro-organismos produzem substâncias e as liberam no meio como forma de se comunicarem e cooperarem entre si. Essas substâncias compartilhadas ou public goods (PGs) contribuem para o crescimento bacteriano e o estabelecimento de biofilmes (Bactérias secretam moléculas que englobam várias populações formando um ambiente interno ideal para o crescimento da comunidade bacteriana, esse biofilme constitui uma camada protetora que isola as bactérias do meio externo, podendo ser impermeável a vários antibióticos. Os biofilmes podem se estabelecer, por exemplo, na superfície dental formando placa bacteriana ou em lentes de contato). O objeto de estudo foi uma substancia compartilhada chamada sideróforo, uma molécula solúvel em água que possui alta afinidade pelo íon férrico (Fe 3+) e é secretada para sequestrar esse íon do meio. No entanto sideróforos também são capazes de se ligar a outros metais, entre eles o Gálio (Ga 3+) que se apresenta como o íon mais semelhante ao férrico. Foi estudado o pyoverdine, principal sideróforo da Pseudomonas aeruginosa (patógeno oportunista, causa infecções no sistema respiratório e urinário, e em casos raros pode causar pneumonia) que se liga ao Ga 3+ com a mesma facilidade com que se liga ao Fe 3+. Uma vez ligado ao gálio o pyoverdine deixa de cumprir sua função para as células que irão definhar com a ausência do íon férrico. Em um dos experimentos comprovou-se que a presença do gálio mesmo fora das células (esse íon é toxico para a P. aeruginosa) inibiu fortemente o crescimento bacteriano e a formação de biofilmes tanto in vitro quanto in vivo.
Em complemento, a fim de investigar empiricamente o potencial de surgimento de resistência ao gálio, foi conduzido um estudo comparando o crescimento bacteriano em populações de P. aeruginosa expostas ao gálio e expostas a um regime de antibióticos comumente usados em infecções por essa bactéria. Inicialmente ambos os tratamentos inibiram o crescimento, mas ao longo dos 12 dias do experimento (tempo normalmente requerido para o tratamento de infecções com antibióticos) o crescimento das populações expostas aos antibióticos aumentou significativamente na medida em que indivíduos resistentes se proliferaram e se tornaram predominantes. No entanto as culturas tratadas com gálio não apresentaram crescimento significativo.
Esse tipo de tratamento é muito promissor uma vez que atua no nível do coletivo e não no ambiente intracelular, onde existem muitas rotas e possibilidades para mutações e desenvolvimento de resistência. Um mutante que não produza o pyoverdine, por exemplo, inicialmente obteria vantagem pois iria usufruir dos sideróforos sintetizados por outras células sem ter que sintetizar o seu próprio, poupando energia; no entanto no tratamento com gálio os sideróforos perderiam sua função e tanto a linhagem mutante quanto a não-mutante pereceriam. Outra possibilidade seria de um mutante que produzisse um numero reduzido de pyoverdine e ao mesmo tempo fosse capaz de utilizar os sideróforos de outras espécies de bactérias como a enterobactina e a desferroxamina (esse mutantes já existem), isso também iria constituir uma mutação vantajosa, inicialmente, mas nessa rota evolutiva a P. aeruginosa necessitaria sempre de uma co-infecção para existir, além disso foi constatado que esses sideróforos também têm alta afinidade ao Ga 3+, assim ambas as espécies teriam seu crescimento interrompido.
| Fenótipo mutante | Por que seria resistente? | Probabilidade de o mutante surgir | Probabilidade do mutante se disseminar |
| Produção de pyoverdine reduzida ou interrompida. | Não haveria resistência mas o mutante não responderia à presença do gálio aumentado a produção de sideróforos. | · Alta· Já existem mutantes desse tipo. | ·Baixa·O gálio diminuiria o numero de indivíduos não-mutantes produtores de pyoverdine e por consequência mutantes. |
| Pyoverdine alterado para se tornar mais eficiente na ligação ao Fe 3+ | O sequestro de íon férrico seria mais eficiente e a população mutante cresceria. | · Baixa· O pyoverdine já é altamente eficiente em se ligar ao Fe 3+ Ainda assim o gálio permanece suficientemente semelhante para se ligar ao pyoverdine | · Baixa· As moléculas de pyoverdine são compartilhadas, então a sua versão mais eficiente também seria utilizada por não-mutantes. |
| Mecanismo regulatório para alterar a produção de pyoverdine para pyochelin (um sideróforo secundário) | Embora o pyochelin seja menos eficiente que o pyoverdine isso pode se mostrar vantajoso em situações de presença de Ga 3+ | · Alta· Esse mecanismo regulatório já existe. | · Baixa· Assim como o pyoverdine, o pyochelin também é compartilhado.
Gálio também pode se ligar ao pyochelin. |
| Redução da produção de pyoverdine + especialização no uso de sideróforos produzidos por outras espécies co-infectantes | Interromper a produção de pyoverdine e utilizar sideróforos de outras espécies se mostra energeticamente vantajoso. | · Baixa· Embora já existam cepas da P. aeruginosa capazes de utilizar sideróforos de outras espécies isso iria requerer uma co-infecção com espécies produtoras de sideróforos compatíveis | · Baixa· A maioria dos sideróforos se liga ao gálio também |
| Produção de agentes redutores como por exemplo a pyocianina que no meio extracelular reduz o Fe 3+ para Fe 2+ | Agentes redutores aumentariam a disponibilidade de compostos mais solúveis que poderiam ser internalizados sem a ajuda dos sideróforos | · Alta· A produção desse agente redutor já existe. | · Baixa· A produção extra de um metabólito gera custo energético extra. Como o pyoverdine a pyocianina é uma molécula compartilhada. |
Ainda há um longo caminho a ser percorrido até o desenvolvimento do antibiótico “à prova da evolução”. O gálio já tem sido utilizado em aplicações na medicina como fármaco de combate a certos tipos de câncer (carcinomas de bexiga e urotelial) e a osteoporose (****). Porém em altas concentrações é tóxico, um dos desafios apresentados é encontrar a concentração correta para impedir o crescimento microbiano sem ser prejudicial ao organismo hospedeiro. O foco em atacar os PGs de organismos microbianos mostra-se então como uma alternativa promissora para substituir os antibióticos convencionais. Muito ainda tem que ser aperfeiçoado e estudado para que o homem atinja um controle tão absoluto sobre a natureza que seja capaz de se antecipar à Evolução, mas se aproxima a passos largos.
(*): http://www.cdc.gov/drugresistance/ —– 12/08/2015
(**): http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=21137 —— 28/05/2015
(***): http://emph.oxfordjournals.org/content/2014/1/18.abstract
(****): http://www.portaldosfarmacos.ccs.ufrj.br/resenhas_galio.html