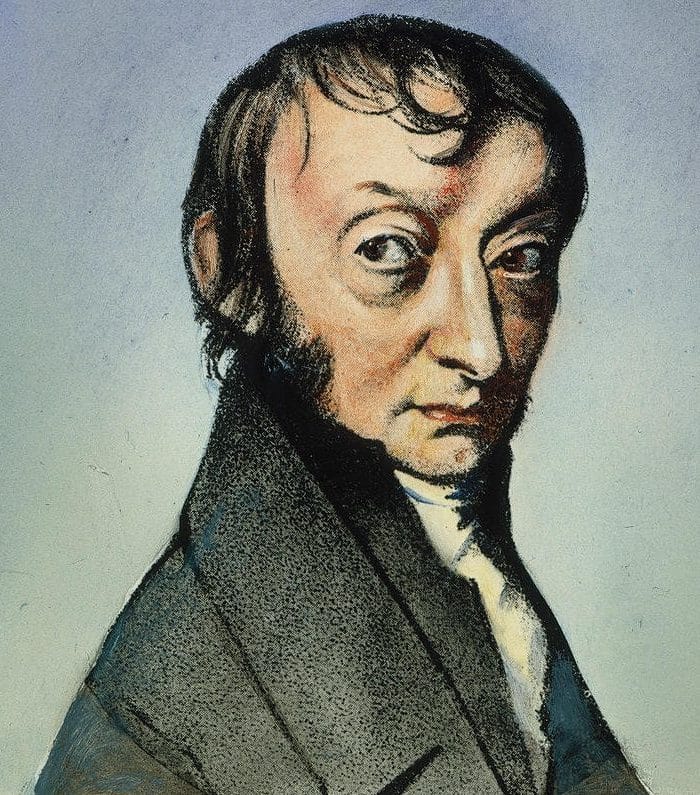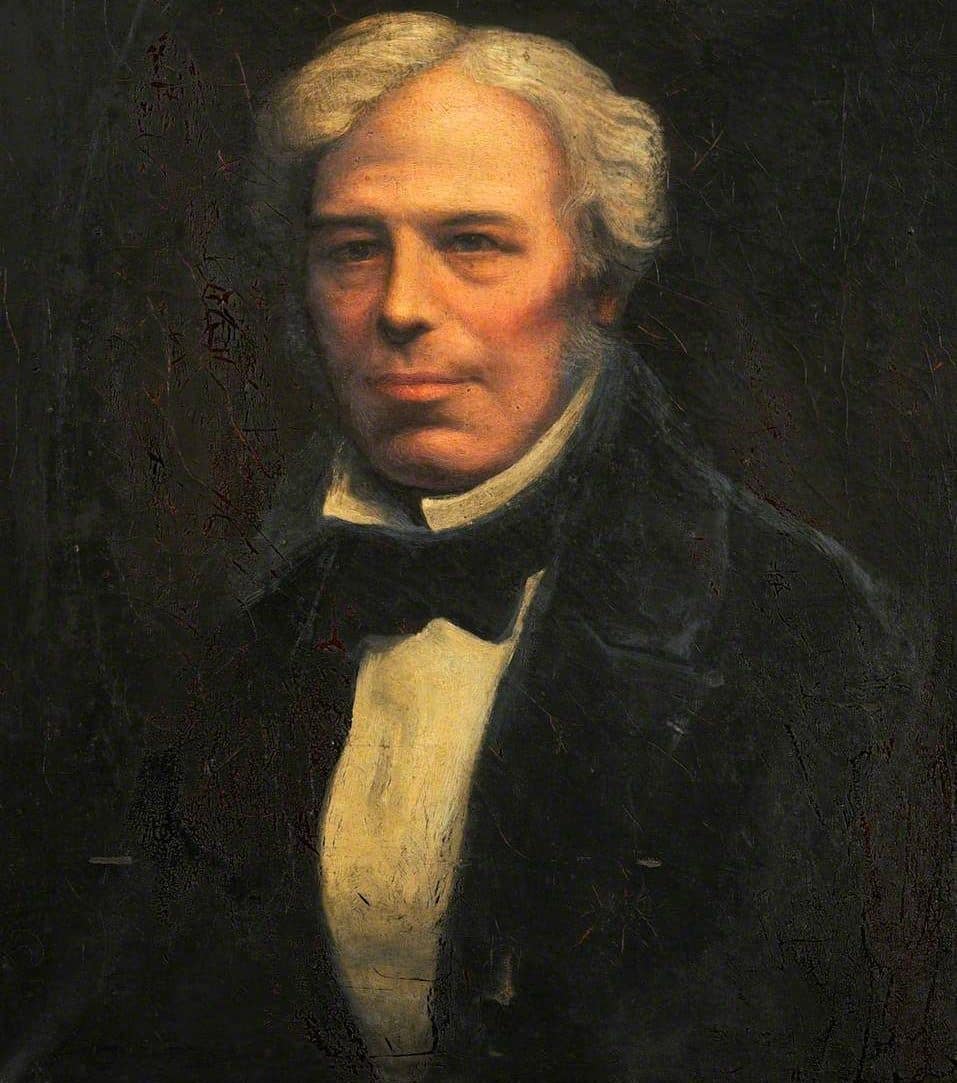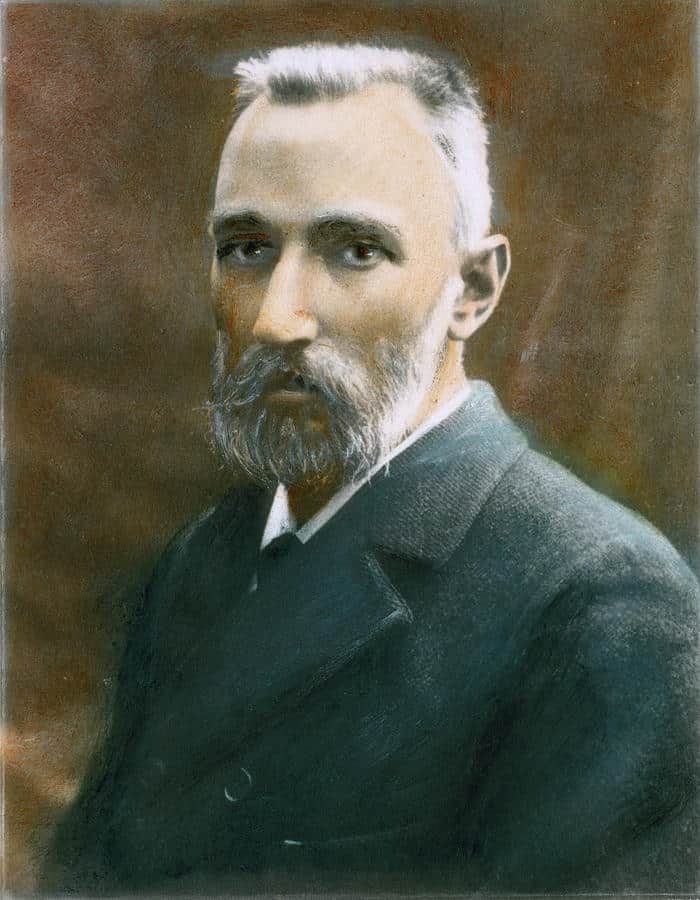Nos últimos dois mil anos, percorremos um longo caminho na ciência. Não pensamos mais que tudo é feito de água ou fogo, por exemplo, ou que o corpo humano é composto de apenas quatro elementos. O campo da química contribuiu muito para esse desenvolvimento, e essa disciplina nos deu um pouco de nosso conhecimento básico do mundo.
Podemos considerar todas essas coisas agora: que o mundo é feito de minúsculas partículas, que você pode queimar coisas como carvão para obter calor. Mas não apenas isso: a química revolucionou a maneira como vivemos nossas vidas – nos oferecendo tecnologias que vão desde a radiação até os painéis solares e a tinta em jeans.
Se muitas pessoas pensam que a química é para o acadêmico, o professor ou o cientista esquisito trajando seu jaleco branco e seus grandes óculos redondos, é importante lembrar que ela é muito mais do que isso e que esses químicos esquisitos mudaram sua vida de mais maneiras do que você provavelmente imagina. Confira a seguir, algumas das mentes mais brilhantes da história da química e descubra o quão cruciais foram suas descobertas para as suas épocas.
Robert Boyle (1627-1691)
Coube ao irlandês Robert Boyle imprimir à química moderna uma orientação metodológica baseada na precisão das medidas e na racionalidade das deduções experimentais. Boyle defendia o uso da publicação detalhada dos trabalhos científicos e a aplicação de experiências controladas para comprovar fatos, abordando tanto o ponto de vista quantitativo quanto o qualitativo. O prefixo alchemy (alquímia) foi eliminado por ele, e a partir daí esse campo de estudo passou a ser denominado de chemistry (química), pois começou a ter uma natureza de ciência realmente, com um discurso cada vez mais concreto e quantitativo. Seus conceitos foram firmados no livro O Químico Cético, publicado em 1661. Na obra, ele ataca a teoria aristotélica dos quatro elementos (terra, ar, fogo e água) e também os três princípios (sal, enxofre e mercúrio) propostos por Paracelso. Com a colaboração de Robert Hooke, Boyle construiu uma bomba pneumática, que permitiu demonstrar a impossibilidade de se obter o vácuo absoluto. Analisando o ar, descobriu que ele serve de meio para a propagação do som; que é constituído de partículas minúsculas que se movem no vácuo; e que seu volume é inversamente proporcional à pressão a que é submetido, dando origem à lei que leva o seu nome. Boyle também foi o fundador da Royal Society e o mecenas que pagou os custos da publicação do Principia de Isaac Newton.
Antoine Lavoisier (1743-1794)

John Dalton (1766-1844)
Amedeo Avogadro (1776-1856)
A famosa lei (às vezes chamada de hipótese) de Avogadro impulsionou a Física e a Química a patamares mais elevados. Isso é digno de nota porque Avogadro viveu em uma época em que os termos “átomo” e “molécula” eram usados alternadamente. Ele tentou arrumar as coisas: começando de onde Gay-Lussac e Dalton pararam. No processo, ele deu início a uma nova era da física de partículas. Suas pesquisas estavam tão à frente de seu tempo que seus contemporâneos não demonstraram interesse por elas. Foi depois de três anos, quando Ampère redescobriu algumas deles, que os cientistas as reconsideraram. Uma série de experimentos de Química Orgânica que Auguste Laurent e Charles-Frédéric Gerhardt conduziram posteriormente, apoiaram a afirmação de Avogadro de que volumes iguais de todos os gases contêm o mesmo número de moléculas (a temperatura e pressão constantes). Vários anos mais se passariam antes que a profundidade das realizações de Avogadro fosse totalmente apreciada. No entanto, suas contribuições consolidaram seu lugar como um dos fundadores da Teoria Molecular. Em sua homenagem, o número de átomos em um mol de qualquer substância é conhecido como constante de Avogadro, cujo valor é igual a 6,02214076 x 1023. Avogadro não calculou este número, mas sua existência decorre logicamente de sua hipótese e trabalho.
Joseph Louis Gay-Lussac (1778-1850)
Joseph Louis Gay-Lussac tinha uma curiosidade insaciável: uma característica que o predispôs a se tornar um dos maiores experimentadores do século XIX. Com a ajuda de balões cheios de hidrogênio, ele subiria alguns quilômetros acima do nível do mar para coletar amostras de ar fresco para análise. Foram muitas dessas análises que o levaram a descobrir que, quando os gases reagem a temperatura e pressão constantes, eles se combinam em volumes que estão em proporções simples; e ao volume do produto (se gasoso). Essa lei do gás ficou conhecida como Lei de Combinação de Volumes de Gay-Lussac e forneceu pistas que inspiraram Avogadro a apresentar sua própria hipótese inovadora, após novas investigações. Além de trabalhar com gases, Gay-Lussac fez outras contribuições notáveis para a química. Ele descobriu o boro, junto com Louis Jacques Thénard e Humphry Davy. E enquanto colaborava com Alexander von Humboldt, descobriu que a água é composta por duas partes de hidrogênio e uma parte de oxigênio por volume. Ele também cunhou os termos: “bureta” e “pipeta” após desenvolver versões aprimoradas de ambos. Suas análises quantitativas de álcoois levaram a França e vários outros países a adotarem “graus Gay-Lussac” como a medida percentual por volume padrão para o etanol.
Humphry Davy (1778-1829)
Na virada do século XIX, a eletricidade estava em alta. As pessoas se dedicavam a fazer baterias e as conectavam a qualquer coisa, só para ver a reação. A eletricidade era como uma nova espécie de fogo. Um dos grandes viciados em baterias na época era Humphry Davy, um químico inglês autodidata. Em 1807, Davy estava realizando um experimento com baterias em seu laboratório. Ele derreteu um pouco de carbonato de potássio, um mineral encontrado no solo que também constitui as cinzas de uma madeira. Os químicos especulavam que o carbonato de potássio era um composto formado por diversos elementos, mas não conseguiam provar isso. Davy queria ver se a eletricidade poderia ter a resposta. Ele instalou alguns fios vindo de uma das baterias maiores ao carbonato de potássio derretido e o potássio puro começou a surgir. Davy havia descoberto o poder da eletricidade de reagir com substâncias químicas e transformá-las. Consequentemente, a eletroquímica levou ao surgimento da indústria do alumínio e à produção de painéis solares, semicondutores, mostradores digitais e até baterias de lítio recarregáveis. Um fato curioso é que seu assistente de laboratório, Michael Faraday, desenvolveu seu trabalho e no final tornou-se mais famoso e influente que ele.
Jacob Berzelius (1779-1848)

Michael Faraday (1791-1867)
Michael Faraday foi principalmente um experimentalista, tendo sido descrito como o “melhor experimentalista na história da ciência”, mesmo não conhecendo matemática avançada, como cálculo infinitesimal. Suas grandes contribuições para a ciência tiveram grande impacto sobre o entendimento do mundo natural. Na química, foi ele quem descobriu o benzeno, produziu os primeiros cloretos de carbono conhecidos (C2Cl6 e C2Cl4) e ajudou a expandir os fundamentos da metalurgia e da metalografia. As suas experiências garantiram o sucesso na liquefação de gases nunca antes liquefeitos (dióxido de carbono e cloro entre outros). Isso tornou possíveis novos métodos de refrigeração cujos princípios continuam a ser utilizados nos modernos refrigeradores domésticos. Talvez a sua maior contribuição tenha sido virtualmente fundar a eletroquímica em conjunto com seu mentor Humphry Davy, descobrindo as leis da eletrólise (que levam o seu nome) e criando termos como eletrólito, ânodo, catodo, eletrodo, e íon. Faraday veio de uma família muito pobre e tornou-se um dos maiores cientistas da história. Sua realização foi notável em uma época em que a ciência era geralmente reservada a pessoas nascidas em famílias ricas. A unidade de capacitância elétrica é denominada farad em sua homenagem.
Dmitri Mendeleev (1834-1907)

Henri Becquerel (1852-1908)
Pierre Curie (1859-1906)
Marie Curie (1867-1934)
Em 1896, Henri Becquerel conduziu uma série de experimentos para verificar se vários minerais emitiam radiação. A partir de seus experimentos, Becquerel conseguiu provar de forma conclusiva a descoberta da fonte dos misteriosos raios radioativos que todos os cientistas procuravam: o urânio. Depois de Becquerel, a pesquisa sobre a radioatividade foi levada adiante por Marie Curie e seu marido Pierre Curie. Eles assumiram a tarefa de isolar quaisquer elementos responsáveis pela radioatividade do minério de urânio. Durante dois anos, os Curie ferveram, filtraram e processaram várias toneladas de minério de urânio. Finalmente, eles conseguiram isolar dois novos elementos contidos no minério: o rádio e polônio. Marie Curie concluiu que o rádio era um milhão de vezes mais radioativo que o urânio e determinou que a misteriosa forma de energia que permitia que a radioatividade penetrasse em outros materiais não era resultado de um processo químico, mas de um processo atômico. Infelizmente, suas descobertas custaram um alto preço. Naquela época, os perigos da exposição à radioatividade não eram muito conhecidos, e em 1934 Marie Curie morreu de leucemia, provavelmente devido à intoxicação causada pela radiação. Desde as descobertas de Becquerel, Pierre e Marie Curie, aprendemos muito sobre a radioatividade. Ela nos deu os diagnósticos por imagem, um tratamento para os tumores, um método de calcular a idade da Terra e uma fonte de energia para que as espaçonaves pudessem explorar o Sistema Solar.
Gilbert Lewis (1875-1946)
No início do século XX, os cientistas queriam entender o mecanismo que permitia que átomos de certos elementos se combinassem com átomos de outros elementos para formar novas substâncias. O químico norte americano Gilbert Lewis desenvolveu um modelo de átomo que forneceu a resposta. Foi ele quem explicou que os elétrons e as ligações químicas dos átomos não estavam no núcleo e que os elétrons orbitam em camadas ao redor do núcleo. No modelo atômico de Lewis, cada camada permitia apenas um número máximo de elétrons. Dois elementos químicos poderiam se combinar para formar um composto quando cediam ou aceitavam elétrons dos seus orbitais externos. Por exemplo: quando um único átomo de sódio cede o elétron de sua última camada e a última camada de um átomo de cloro o aceita, essa troca permite que os dois se liguem e formem o composto cloreto de sódio, o sal de cozinha. A descoberta da ligação covalente por Gilbert Lewis permitiu que os cientistas começassem a fazer milhões de compostos químicos, que moldaram a face da vida moderna. Lewis também contribuiu com sucesso para termodinâmica química, fotoquímica e separação isotópica, e é conhecido por seu conceito de ácidos e bases. Embora tenha sido indicado 41 vezes, ele nunca ganhou o Prêmio Nobel de Química, resultando em uma grande polêmica e injustiça do Prêmio Nobel.
Linus Pauling (1901-1994)
Leia mais artigos da série doze mentes brilhantes:
A série doze mentes brilhantes celebra a memória e o legado dos maiores cientistas, filósofos e comunicadores científicos de todos os tempos. O mundo hoje habita na morada do avanço científico em diferentes setores da ciência por causa dessas personalidades.
As doze mentes mais brilhantes da história da ciência
As doze mentes mais brilhantes da história da astronomia
As doze mentes mais brilhantes da história da física
As doze mentes mais brilhantes da história da matemática
As doze mentes mais brilhantes da história da biologia
As doze mentes mais brilhantes da história da medicina
As doze mentes mais brilhantes da história da genética
As doze mentes mais brilhantes da história da paleontologia
As doze mentes mais brilhantes da história da geologia
As doze mentes mais brilhantes da história da computação
As doze mentes mais brilhantes da história da astronáutica
As doze mentes mais brilhantes da história da divulgação científica
As doze mentes mais brilhantes da história da literatura de ficção científica
*Henri Becquerel, Pierre Curie e Marie Curie compartilham a mesma posição e biografia na lista por dividirem historicamente o crédito pela descoberta da radioatividade.